PLATAFORMA EAD CIENCO
(COMUNIDADE CIENCO)
Torne-se um analista indispensável e conquiste
os cargos mais altos!
Assine a plataforma mais completa em cursos voltados para a área analítica farmacêutica industrial e esteja sempre pronto para o mercado de trabalho
Conheça a Comunidade Cienco
em detalhes

A Comunidade Cienco é a sua Netflix da Indústria Farmacêutica,
com tudo o que você precisa para alcançar os cargos mais altos:
Todos os nossos cursos projetados para transformar você em um profissional altamente comprometido, atualizado, com conhecimento profundo, ou seja: indispensável e preparado para assumir posições de confiança como analista, tornando-se uma referência dentro e fora da sua equipe.
Explore a Comunidade Cienco

1
De imediato, você terá acesso à TODOS os cursos completos, com cerca de 400 horas em vídeo aulas, organizados na Plataforma EAD da Cienco, com materiais em PDF, certificados, os quais você terá acesso pelo período que for contratado e ferramentas de diagnóstico técnico que irão permitir visualizar o seu avanço nos mais diversos assuntos. Parece mentira, eu sei!! Mas é real!
2
Como aluno, você poe ser também um afiliado, tendo a oportunidade de transformar a Comunidade Cienco em um negócio lucrativo de imediato. Além de desenvolver suas habilidades e crescer na carreira, você pode compartilhar o conhecimento adquirido e atrair novos alunos, recebendo comissões de 20 a 50% por cada indicação. Bom demais, não é mesmo?
3
As mentorias individuais são opcionais e alunos da P-EAD Cienco tem 50% de desconto nos nossos encontros. Elas oferecem o grau máximo de conexão e acolhimento, proporcionando um espaço totalmente seguro, onde você receberá um direcionamento personalizado, alinhando suas estratégias de carreira de forma a superar desafios e alcançar seus objetivos com confiança.
TÉCNICAS ANALÍTICAS

As técnicas analíticas são as principais ferramentas pra você trabalhar nos laboratórios farmacêuticos.
Porém, para que você ou sua equipe trabalhe com resultados confiáveis, com autonomia, cumprindo com prazos e custos estabelecidos pela empresa, você não pode somente conhecer, VOCÊ PRECISA DOMINAR AS TÉCNICAS.
Descrição:
A Cromatografia a Líquido de Alta e Ultra Eficiência (HPLC e UHPLC) é uma técnica analítica indispensável para as indústrias químicas e farmacêuticas, representando um diferencial competitivo no mercado de trabalho. Com mais de 90% das vagas no setor analítico exigindo domínio dessa técnica, este curso foi desenvolvido para oferecer um conhecimento sólido e aplicado, capacitando você para atender às demandas mais exigentes do mercado.
Ementa:
- Fundamentos Químicos da Cromatografia Líquida: Compreensão dos princípios químicos que embasam a técnica, abordando aspectos como polaridade, interações moleculares e equilíbrio químico.
- Introdução à Cromatografia: Conceitos e Aplicações: Exploração das bases da cromatografia, suas principais aplicações na indústria farmacêutica e química, e os diferentes tipos de técnicas cromatográficas disponíveis.
- Estrutura e Funcionamento do Sistema Cromatográfico: Estudo detalhado dos componentes do equipamento, como bomba, injetor, coluna e detector, com foco em sua função e otimização para análises confiáveis.
- Detectores UV-Vis e Pureza de Picos: Entendimento avançado dos detectores mais utilizados, técnicas para análise de pureza de picos e interpretação de dados cromatográficos.
- Planejamento de Métodos Analíticos: Estratégias para desenvolvimento de métodos cromatográficos, incluindo seleção de fases móveis, fases estacionárias e parâmetros de separação.
- Resolução de Problemas em Cromatografia: Abordagem prática para diagnóstico e solução de problemas recorrentes durante análises cromatográficas, visando manter a integridade e eficiência dos resultados.
- Gerenciamento de Resultados e Análise de Dados: Métodos para tratamento, validação e interpretação de dados, com foco na consistência e confiabilidade dos resultados obtidos.
- Estudos de Caso e Aplicação Prática: Discussão de casos reais que ilustram a aplicação prática dos conceitos aprendidos, promovendo a resolução de desafios comuns em cromatografia líquida.
Carga horária: 20 horas
Descrição:
O curso Empower 3 oferece uma imersão prática na utilização de um dos softwares de gerenciamento e análise cromatográfica mais avançados do mercado. Indispensável para laboratórios analíticos, o Empower 3 permite o controle de equipamentos, aquisição de dados e tratamento de resultados com alto grau de precisão e confiabilidade. Este curso capacitará os participantes a operar o software com autonomia, maximizando a eficiência analítica e a qualidade dos resultados.
Ementa:
- Visão Geral do Empower 3: Introdução às funcionalidades e benefícios do software no gerenciamento de análises cromatográficas.
- Configuração Inicial e Perfis de Usuário: Passo a passo para a configuração do sistema e criação de perfis de usuário, com níveis de acesso personalizados.
- Aquisição de Dados Cromatográficos: Configuração de métodos, coleta de dados e monitoramento em tempo real.
- Processamento e Integração de Dados: Estratégias para processamento automático e manual de dados cromatográficos, incluindo ajuste de integrações e cálculos personalizados.
- Pureza de Picos e Biblioteca de Espectros: Técnicas para análise de pureza de picos e utilização de bibliotecas espectrais, garantindo a identificação precisa de compostos e a integridade dos resultados.
- Sequência de Injeções para Curva de Calibração: Configuração de sequências de injeções para construção de curvas de calibração utilizando padrões externos e internos, garantindo a precisão analítica.
- Geração de Relatórios em PDF: Configuração e personalização de relatórios no formato PDF, incluindo layout, dados essenciais e opções para auditorias e conformidade regulatória.
Carga horária: 10 horas
Descrição:
A técnica de Cromatografia a Líquido acoplada à Espectrometria de Massas é a técnica analítica ideal para análise de impurezas e, principalmente, para substâncias desconhecidas. Isso faz com que seja também muito exigida para estudos de degradação forçada de fármacos e controle de impurezas em baixíssimas concentrações.
Ementa:
- Fundamentos de Química Aplicados à Espectrometria de Massas: Introdução aos princípios químicos essenciais que sustentam as técnicas de espectrometria de massas, com foco na sua aplicação em análises avançadas.
- Principais Fontes de Ionização e Otimização para Acoplamento com LC: Exploração das principais técnicas de ionização utilizadas na espectrometria de massas e dos parâmetros críticos para otimização no acoplamento com cromatografia líquida (LC).
- Diferentes Tipos de Focalizadores de Íons: Análise das tecnologias e mecanismos dos focalizadores de íons, que são fundamentais para direcionar e concentrar os íons no sistema de espectrometria de massas.
- Cinco Principais Tipos de Analisadores de Massas: Descrição detalhada dos cinco tipos mais importantes de analisadores de massas, incluindo suas características, aplicações e vantagens em diferentes contextos analíticos.
- Operação e Manutenção do Detector de Massas: Guia prático sobre o funcionamento do detector na espectrometria de massas, com ênfase nos cuidados e práticas de manutenção para garantir a longevidade e precisão dos resultados.
- Experimentos de Fragmentação e Seleção de Íons: Discussão dos diferentes tipos de experimentos de fragmentação e técnicas de seleção de íons, essenciais para a identificação e caracterização de compostos.
- Mecanismos de Fragmentação a Baixa Energia: Análise dos processos de fragmentação que ocorrem sob condições de baixa energia, com foco na interpretação dos espectros resultantes.
- Discussão de Casos Reais: Aplicação em Espectrometria de Massas: Estudo de exemplos práticos que ilustram a aplicação dos conceitos e técnicas de espectrometria de massas em cenários do mundo real, com foco na solução de problemas analíticos.
Carga horária: 20 horas
Descrição:
A técnica de Cromatografia a Gás vem tomando espaço nas indústrias farmacêuticas, seja para controle de solventes residuais ou análise de impurezas termicamente estáveis e voláteis.
Ementa:
- Fundamentos de Química Aplicados à Cromatografia a Gás: Exploração dos princípios químicos essenciais que sustentam a técnica de cromatografia a gás, com ênfase em sua aplicação para análises precisas de compostos voláteis.
- Cromatografia: Conceitos, Aplicações e Formatos: Definição abrangente de cromatografia, focando nas suas diversas aplicações na indústria e nos formatos específicos utilizados na cromatografia a gás.
- Equipamentos de Cromatografia a Gás: Análise Detalhada Módulo por Módulo: Descrição detalhada dos componentes de um sistema de cromatografia a gás, abordando o funcionamento e a importância de cada módulo para obter resultados confiáveis.
- Técnicas de Injeção de Amostras em Cromatografia a Gás: Análise aprofundada dos métodos de injeção de amostras, destacando as melhores práticas para garantir a precisão e a reprodutibilidade das análises.
- Desenvolvimento Analítico: Otimização das Rampas de Temperatura: Estratégias para o desenvolvimento de métodos cromatográficos, com foco na otimização das rampas de temperatura para melhorar a separação dos compostos.
- Desenvolvimento Analítico: Seleção e Uso de Fases Estacionárias: Discussão sobre a escolha das fases estacionárias adequadas e como sua correta aplicação pode impactar positivamente nos resultados analíticos.
- Gestão de Falhas, Modificações e Resultados Esperados: Identificação de problemas comuns durante a execução de métodos cromatográficos, com sugestões de modificações e expectativas realistas de resultados após ajustes.
- Discussão de Casos Reais: Aplicação Prática dos Conceitos: Análise de estudos de casos reais que ilustram a aplicação prática dos conceitos e técnicas discutidos, focando em soluções eficazes para desafios comuns na cromatografia a gás.
Carga horária: 20 horas
Descrição:
A técnica de Cromatografia a Gás acoplada à Espectrometria de Massas é muito utilizada para análise de substâncias voláteis e termicamente estáveis, como por exemplo algumas Nitrosaminas, substâncias genotóxicas
Ementa:
- Fundamentos de Química Aplicados à Espectrometria de Massas: Introdução aos princípios químicos essenciais que sustentam as técnicas de espectrometria de massas, com foco na sua aplicação em análises avançadas e precisas.
- Fontes de Ionização e Otimização para Acoplamento com GC: Exploração das principais técnicas de ionização usadas na espectrometria de massas e como otimizar parâmetros para um acoplamento eficaz com cromatografia a gás (GC).
- Principais Tipos de Analisadores de Massas: Descrição detalhada dos principais tipos de analisadores de massas, destacando suas características, aplicações e vantagens em diferentes contextos analíticos.
- Operação e Manutenção do Detector de Massas: Guia prático sobre o funcionamento do detector na espectrometria de massas, com ênfase nos cuidados e práticas de manutenção para garantir a precisão e a longevidade dos resultados.
- Experimentos de Fragmentação e Seleção de Íons: Discussão dos diferentes tipos de experimentos de fragmentação e técnicas de seleção de íons, essenciais para a identificação e caracterização de compostos.
- Mecanismos de Fragmentação a Alta Energia: Análise dos processos de fragmentação que ocorrem sob condições de alta energia, com foco na interpretação dos espectros resultantes e suas aplicações em identificação molecular.
- Discussão de Casos Reais: Estudo de exemplos práticos que ilustram a aplicação dos conceitos e técnicas de espectrometria de massas em cenários do mundo real, com foco na solução de problemas analíticos.
Carga horária: 10 horas
Descrição:
AA, ICP-OES e ICP-MS são as técnicas analíticas para análise de compostos elementares. O uso das técnicas vem crescendo muito nas indústrias farmacêuticas para controle impurezas de síntese e provenientes de embalagens (Extraíveis e Lixiviáveis).
Ementa:
- Fundamentos de Química Aplicados à Análise Elementar: Exploração dos princípios químicos essenciais que fundamentam as técnicas de análise elementar, com foco na identificação e quantificação de elementos em diferentes matrizes.
- Preparo de Amostras para Análise Elementar: Técnicas e melhores práticas para o preparo adequado de amostras, garantindo a precisão e a reprodutibilidade dos resultados nas análises elementares.
- Equipamento e Desenvolvimento Analítico: Absorção Atômica (AA): Descrição detalhada do funcionamento, aplicação e otimização de métodos analíticos utilizando espectrometria de absorção atômica.
- Equipamento e Desenvolvimento Analítico: ICP-OES: Análise do uso da espectrometria de emissão óptica com plasma acoplado indutivamente (ICP-OES) para a determinação de elementos, incluindo aspectos de desenvolvimento de métodos.
- Equipamento e Desenvolvimento Analítico: ICP-MS: Exploração do uso da espectrometria de massas com plasma acoplado indutivamente (ICP-MS), focando no desenvolvimento analítico para detecção ultra sensível de elementos.
- Gestão de Falhas, Modificações e Resultados Esperados: Identificação e correção de problemas comuns em análises elementares, com sugestões de modificações e expectativas de resultados após ajustes.
- Discussão de Casos Reais: Aplicação em Análise Elementar: Estudo de exemplos práticos que demonstram a aplicação dos conceitos e técnicas de análise elementar em situações reais, com foco na solução de problemas e melhoria de processos.
Carga horária: 20 horas
LEGISLAÇÕES E PROCEDIMENTOS
Além do domínio das técnicas analíticas, é fundamental dominar também as leis e os procedimentos, pra que você não fique trabalhando em vão, ou “inventando a roda” se já existem formas de realizar e orientações de especialistas dedicados nos assuntos, presentes nas indústrias farmacêuticas.
Esteja sempre atualizado com as legislações da Anvisa e ICH.
Descrição:
Muitos profissionais, ao ingressar na indústria farmacêutica, ainda não têm com clareza de quais são os departamentos e de como eles se comunicam. É de extrema importância que o profissional saiba onde o trabalho dele se encaixo no todo e quais são as expectativas da empresa na hierarquia entre os cargos jr, pl, sr e especialista.
Ementa:
Estrutura da Indústria Farmacêutica: Visão geral das principais áreas e setores que compõem a indústria farmacêutica, desde pesquisa e desenvolvimento até a produção e controle de qualidade, destacando como cada setor interage para garantir a eficácia e segurança dos medicamentos.
Legislações Importantes no Ciclo de Vida do Medicamento: Análise das principais regulamentações que governam todas as fases do ciclo de vida de um medicamento, desde o desenvolvimento até a pós-comercialização, incluindo normas nacionais e internacionais.
Hierarquia dentro da Indústria Farmacêutica: Descrição das diferentes posições hierárquicas na indústria farmacêutica, com foco nas responsabilidades e expectativas em cada nível, desde analistas até posições de liderança.
Como Evoluir na Hierarquia Analítica: Estratégias e passos práticos para progredir na carreira dentro da hierarquia analítica, desde o nível júnior até cargos sêniores e de especialista, destacando as competências técnicas e comportamentais necessárias.
Exemplos Práticos dos Diferentes Analistas: Estudo de casos reais que ilustram as funções e desafios enfrentados por analistas em diferentes níveis da hierarquia, mostrando como suas responsabilidades evoluem à medida que avançam na carreira.
Mitos ou Verdades Analíticas: Desmistificação de conceitos e crenças comuns na área analítica, confrontando mitos com a realidade prática e oferecendo uma compreensão clara do que realmente importa para o sucesso na indústria farmacêutica.
Carga horária: 10 horas
Descrição:
A RDC 53/2015 informa as exigências para o estudo de degradação forçada de fármacos. O curso apresenta e detalha a lei e a forma como se desenvolve um estudo de degradação forçada até a elaboração de relatório final.
Ementa:
Perfil de Impurezas: Definição e caracterização das impurezas presentes no fármaco, essenciais para garantir a qualidade e segurança do produto final.
Limites de Especificação (LN, LI, LQ): Estabelecimento dos limites de notificação, identificação e quantificação para garantir o controle rigoroso das impurezas.
Predição da Degradação Forçada: Análise das condições que podem levar à degradação do fármaco, utilizando métodos para prever o comportamento do produto ao longo do tempo.
Avaliação de Grupos Funcionais e Interações Fármaco-Excipiente: Estudo dos grupos funcionais mais suscetíveis à degradação e das interações comuns entre fármaco e excipientes que podem impactar a estabilidade.
Estudo de Degradação Forçada: Planejamento e execução de testes de degradação forçada para avaliar a estabilidade do fármaco sob condições extremas.
Determinação do “End Point”: Identificação do ponto final no processo de degradação, crucial para entender o limite de estabilidade do produto.
Cálculo do Balanço de Massas: Realização de cálculos para garantir que todos os produtos de degradação sejam contabilizados corretamente, assegurando a precisão dos resultados.
Correlação entre Queda de Teor e Formação de Produtos de Degradação: Análise da relação entre a diminuição do teor do fármaco e o surgimento de produtos de degradação, informando as decisões sobre a estabilidade do produto.
Carga horária: 10 horas
Descrição:
A estatística vem tomando espaço nas principais indústrias farmacêuticas. Pudera, pois é com a análise numérica e gráfica que conseguimos adequar e viabilizar processos, os quais sem as ferramentas adequadas seria impossível ou daria gastos indevidos à empresa, inconformidades, retrabalho, dentre outros. Utilizar a estatística para otimização do desenvolvimento analítico traz ao laboratório economia de tempo e dinheiro, além de proporcionar o trabalho com equipe multidisciplinar.
Ementa:
Histórico e Evolução da Qualidade na Indústria Farmacêutica: Análise do desenvolvimento histórico dos padrões de qualidade e sua importância na indústria farmacêutica.
Conceitos de QbD e AQbD: Exploração dos princípios e terminologias do Quality by Design (QbD) e Analytical Quality by Design (AQbD), e sua aplicação no desenvolvimento farmacêutico.
Diretrizes ICH e Desenvolvimento Farmacêutico: Estudo das diretrizes ICH Q8 para desenvolvimento farmacêutico e ICH Q14 (em consulta pública) focadas em AQbD.
Ciclo de Vida de Métodos Analíticos (Method Life Cycle): Conceito e aplicação do ciclo de vida de métodos analíticos, incluindo sua relevância para a estabilidade e qualidade dos produtos.
Desenvolvimento Empírico e AQbD: Comparação entre o desenvolvimento empírico (OFAT) e o approach sistemático do AQbD para otimização de processos.
Gestão de Riscos na Qualidade: Aplicação das diretrizes da ABNT NBR ISO 31.000/2018 e do ICH Q9 para gerenciamento de riscos em processos analíticos.
Ferramentas de Análise de Riscos: Uso de técnicas como Brainstorming, Técnica Delphi, Diagrama de Ishikawa, FMEA e Checklists para identificação e mitigação de riscos.
Planejamento e Validação do Design Space (DS) e MODR: Determinação e validação do Design Space e do Method Operable Design Region (MODR), alinhados às diretrizes da USP-NF <1220> e seu impacto nas normas RDC 301/2019, RDC 200/17 e RDC 73/2016.
Carga horária: 10 horas
Descrição:
Validar um método analítico é dar a confiabilidade do mesmo, com medições e avaliações estatísticas. O analista deve conhecer as técnicas analíticas, os parâmetros de validação, o software de cálculo e a RDC 166/2017
Ementa:
Fundamentos da Validação Analítica: Introdução aos conceitos-chave e à importância da validação analítica no controle de qualidade farmacêutico.
Preparo de Amostras para Validação: Procedimentos e melhores práticas para garantir a precisão e reprodutibilidade na validação de amostras.
Parâmetros Críticos de Validação Analítica: Revisão dos parâmetros essenciais, como precisão, exatidão, linearidade e especificidade.
RDC 166/2017: Normas e Aplicações: Análise detalhada da RDC 166/2017 e sua aplicação na validação de métodos analíticos.
Aplicação Prática com Action Stat: Realização de exercícios práticos utilizando o software Action Stat para fortalecer o entendimento dos conceitos de validação.
Identificação e Correção de Falhas na Validação: Discussão sobre falhas comuns na validação, estratégias de modificação e os resultados esperados após ajustes.
Estudos de Casos Reais: Análise de casos práticos para ilustrar a aplicação dos conceitos de validação em situações do mundo real.
Documentação e Relatórios de Validação: Elab
Carga horária: 10 horas
Descrição:
Os equipamentos de produção de meicamentos devem passar pelo procedimento de limpeza mais adequado e, para não ter contaminação cruzad, é preciso analisar. Pra isso, é necessário validar o método para análise de resíduos de limpeza. fármacos e controle de impurezas em baixíssimas concentrações.
Ementa:
Instrução Normativa IN 47: Análise detalhada da IN 47 e suas implicações para a validação analítica de resíduos de limpeza.
Etapas da Validação Analítica de Resíduos de Limpeza: Descrição das fases essenciais do processo de validação, desde a amostragem até a análise final.
Legislação Aplicável à Validação de Resíduos: Revisão das principais normas e regulamentos que regem a validação analítica de resíduos de limpeza na indústria farmacêutica.
Iniciando a Validação de Resíduos de Limpeza (VMA): Guia prático sobre como começar a VMA, incluindo a definição de objetivos e critérios de aceitação.
Desenvolvimento Passo-a-Passo da Validação: Estruturação detalhada das etapas para conduzir uma validação eficaz, com foco em garantir a conformidade e a segurança.
Métodos Específicos para Detergentes: Discussão dos métodos analíticos utilizados para detectar e quantificar resíduos de detergentes em superfícies de equipamentos.
Desafios e Soluções na VMA: Identificação dos principais desafios na validação de resíduos de limpeza e as melhores práticas para superá-los.
Documentação e Relatórios de VMA: Orientações para a correta documentação de todo o processo de validação, garantindo conformidade com as exigências regulamentares.
Carga horária: 5 horas
Descrição:
A estatística vem tomando espaço nas principais indústrias farmacêuticas. Com a análise numérica e gráfica conseguimos adequar e viabilizar processos. Ter conhecimento em estatística é, atualmente, um diferencial na área farmacêutica!
Ementa:
População e Amostra: Conceitos Estatísticos Fundamentais: Definição e diferenciação entre população e amostra, e sua importância na análise estatística.
Tendência Central e Medidas de Dispersão: Análise das variáveis centrais (média, mediana, moda) e das medidas de dispersão (variância, desvio padrão) para descrever a distribuição dos dados.
Teste de Hipóteses e Determinação de Outliers: Metodologias para testar hipóteses estatísticas e identificar valores aberrantes que podem impactar a análise.
Comparação entre Variâncias e Médias: Técnicas estatísticas para comparar variâncias e médias entre diferentes grupos de dados.
Intervalo de Confiança e Regressão Linear: Cálculo e interpretação de intervalos de confiança, e aplicação de regressão linear para modelagem de relações entre variáveis.
ANOVA: Análise de Variância: Uso da ANOVA para comparar múltiplas médias e avaliar se as diferenças observadas são estatisticamente significativas.
Exatidão, Precisão e Avaliação de Sistemas: Avaliação da exatidão e precisão em sistemas analíticos, incluindo a adequação dos métodos utilizados.
Transferências de Tecnologia e Estudos Colaborativos: Procedimentos para a transferência de tecnologia e a importância de estudos colaborativos na padronização e validação de processos.
Carga horária: 5 horas
Descrição:
O teste de dissolução é uma ferramenta muito importante na indústria farmacêutica, tanto no desenvolvimento de rodutos quanto no controle de qualidade de rotina. Os testes de issolução são usados não só para as formar sólidas, mas também nas formas não sólidas, como suspensões, adesivos transdérmicos, supositórios e outras. A RDC que rege esse assunto é a RDC 31/2010 com o Guia 14. No nosso curso, você aprenderá não somente sobre a técnica, manipulação e toda teoria envolvida, mas também sobre a lei e como executar um trabalho com muita confiança e responsabilidade!
Ementa:
Fundamentos de Dissolução e Difusão: Introdução aos conceitos básicos de dissolução e os princípios de difusão que regem a liberação de fármacos.
Fatores que Influenciam Solubilidade e Dissolução: Análise dos fatores que afetam a solubilidade dos compostos e a eficiência do processo de dissolução.
Parâmetros e Aparatos de Dissolução: Discussão sobre os principais parâmetros de dissolução e os equipamentos utilizados para conduzir esses testes.
Perfis de Dissolução e Comparação de Perfis: Avaliação de perfis de dissolução e técnicas para comparar diferentes perfis de liberação de fármacos.
Correlação In Vivo-In Vitro e Modelos Estatísticos: Estabelecimento de correlações entre resultados laboratoriais e comportamento in vivo, utilizando modelos estatísticos.
Legislação e Normas Regulatórias: Revisão das principais regulamentações, incluindo RDC 31, Guia 14, ICH, FDA, EMA, e outras normas relevantes.
Desenvolvimento de Métodos de Dissolução e Uso de Tensoativos: Estratégias para o desenvolvimento de métodos robustos de dissolução e a aplicação de tensoativos para melhorar a solubilidade.
Aplicação em Desenvolvimento de Novos Produtos e Estudos de Casos: Uso de testes de dissolução no desenvolvimento de novos produtos, com exemplos práticos e estudos de casos reais.
Carga horária: 20 horas
Descrição:
A Farmacopéia Americana (USP 29) define estabilidade como o período no qual um produto retém, dentro de limites especificados, e por todo o seu período de armazenamento e uso, as propriedades e características que o produto possuía na hora de sua produção. Ela se difere em estabilidade física, química, microbiológica, terapêutica e toxicológica. A estabilidade química é a capacidade do fármaco em manter a identidade molecular diante de fatores como temperatura, umidade, luz e pH. A RDC 318/2019 é a lei que rege os estudos de estabilidade e, no nosso curso, você aprenderá o passo-a-passo de como realizar esse trabalho na indústria farmacêutica.
Ementa:
RDC 318/2019 e Guia 14/2018: Análise das diretrizes para estudos de estabilidade de insumos farmacêuticos e medicamentos, conforme a RDC 318/2019 e Guia 14/2018.
Importância dos Estudos de Estabilidade: Compreensão do propósito e da relevância dos estudos de estabilidade para garantir a qualidade e segurança dos medicamentos ao longo do tempo.
Métodos Indicativos de Estabilidade e Adequabilidade Analítica: Exploração dos métodos indicativos de estabilidade e sua conformidade com as RDCs 53/2015 e 45/2012.
Tipos e Zonas Climáticas nos Estudos de Estabilidade: Discussão sobre os diferentes tipos de estudos de estabilidade, considerando as zonas climáticas e as condições específicas de cada estudo.
Protocolo e Condições de Estabilidade: Elaboração de protocolos de estabilidade, incluindo a definição de condições e frequência de testes para monitorar a qualidade dos medicamentos.
Avaliação e Interpretação de Dados de Estabilidade: Métodos para avaliar os dados coletados durante os estudos de estabilidade e interpretar os resultados para assegurar a conformidade com as normas regulatórias.
Estudos de Estabilidade Pós-Registro: Importância dos estudos de estabilidade após o registro do medicamento para garantir sua eficácia e segurança contínuas no mercado.
Guia para Estudos de Dissolução: Revisão das propostas de guias para estudos de dissolução, abordando sua integração com os estudos de estabilidade e desenvolvimento de medicamentos.
Carga horária: 10 horas
Descrição:
Registro e pós-registro de medicamentos mostra que a indústria farmacêutica está em constante desenvolvimento, buscando condições de melhorias contínuas. Pra isso, é preciso entender quais são as leis e os processos internos para sempre estar com as condições adequadas segundo às exigências da Anvisa.
Ementa:
Histórico e Evolução Regulatória: Revisão do desenvolvimento histórico das principais normas regulatórias que influenciam a indústria farmacêutica.
Revisão da RDC 53/2015 e RDC 753/2022: Análise das atualizações e mudanças introduzidas pela RDC 53/2015 e RDC 753/2022, e seus impactos na prática laboratorial.
Guias 59, 60 e 61/2023: Compreensão das diretrizes estabelecidas pelos Guias 59, 60 e 61/2023 e sua aplicação nas operações da indústria farmacêutica.
Comparativo de Normas: RDC 443/2020 e RDC 73/2016: Discussão sobre as semelhanças e diferenças entre essas normas e como elas impactam a rotina laboratorial.
Desdobramentos e Links Regulatórios: Exploração dos desdobramentos das regulamentações e como elas se interconectam, influenciando o cumprimento das normas.
Construção de PATE (Protocolos Analíticos e Técnicos Específicos): Guia para a elaboração de PATEs eficazes, garantindo conformidade e eficiência no processo analítico.
Desenvolvimento de Justificativas Técnicas: Estruturação de justificativas técnicas robustas para atendimento às exigências regulatórias e defesa de metodologias empregadas.
Extraíveis e Lixiviáveis em Pré e Pós-Registro: Abordagem dos requisitos para estudos de extraíveis e lixiviáveis antes e depois do registro de medicamentos, assegurando a segurança e a conformidade dos produtos.
Carga horária: 10 horas
Descrição:
O Controle da Qualidade Fisíco-Químico é uma das áreas vitais para a indústria farmacêutica e devem ter laboratórios próprios e independentes da produção. Esta área tem o objetivo de analisar os produtos recebidos e fabricados conforme os métodos e especificações padronizadas e registradas junto ao órgão regulador.
Ementa:
Fundamentos do Controle de Qualidade Físico-Químico: Introdução aos conceitos essenciais que sustentam o controle de qualidade físico-químico na indústria farmacêutica.
Boas Práticas e Segurança em Laboratórios Analíticos: Normas e diretrizes para garantir a segurança e a conformidade nas operações laboratoriais.
Responsabilidades no Controle de Qualidade Físico-Químico: Exploração das principais atribuições e responsabilidades dos profissionais envolvidos no controle de qualidade.
Conceitos Básicos dos Estudos de Estabilidade: Compreensão dos princípios fundamentais dos estudos de estabilidade e sua importância na garantia da qualidade dos medicamentos.
Gestão de Resultados Fora de Especificação e Tendência: Abordagem para identificar, analisar e corrigir resultados que estão fora da especificação ou tendência esperada.
Aplicação de Estatística no Controle de Qualidade: Utilização de ferramentas estatísticas, como Minitab, ANOVA, intervalo de confiança e ANCOVA, para análise de dados no controle de qualidade.
Impacto do Erro em Métodos Analíticos: Avaliação do impacto dos erros em métodos analíticos e estratégias para minimizá-los, garantindo resultados precisos e confiáveis.
Discussão de Casos Reais: Análise de exemplos práticos que ilustram a aplicação dos conceitos e técnicas de controle de qualidade físico-químico em situações reais.
Carga horária: 15 horas
Descrição:
Apresentar os conceitos fundamentais de qualidade em laboratórios através dos requisitos de Boas Práticas de Laboratório. de acordo com o guia NIT-DICLA-035/04.
Ementa:
Organização e Pessoal da Instalação de Teste: Estrutura organizacional e qualificações necessárias do pessoal envolvido em testes para garantir a integridade e a conformidade dos estudos.
Programa de Garantia da Qualidade: Desenvolvimento e implementação de um programa de qualidade robusto para assegurar que os testes atendam às normas regulatórias e padrões internos.
Instalações e Infraestrutura: Requisitos para a configuração e manutenção de instalações de teste adequadas, garantindo condições controladas para a realização dos estudos.
Equipamentos, Materiais e Reagentes: Seleção, calibração e manutenção de equipamentos, além da gestão de materiais e reagentes, para garantir a precisão e confiabilidade dos resultados.
Sistema de Teste e Itens de Referência: Estabelecimento e controle dos sistemas de teste, incluindo a seleção e uso apropriado de itens de teste e de referência.
Procedimentos Operacionais Padrão (POPs): Criação e implementação de procedimentos operacionais padrão para assegurar a consistência e a repetibilidade nos estudos.
Execução e Relato de Estudos: Diretrizes para a execução rigorosa dos estudos, acompanhadas por relatórios detalhados e precisos dos resultados obtidos.
Armazenamento e Retenção de Registros e Materiais: Políticas para o armazenamento seguro e retenção de registros e materiais de estudo, garantindo a disponibilidade para auditorias e revisões futuras.
Carga horária: 10 horas
Descrição:
Um Sistema de Gestão da Qualidade (SGQ) constitui um conjunto de práticas, com o objetivo de orientar cada área de uma Instituição para que execute, corretamente e no tempo devido, suas tarefas, em harmonia com as demais áreas que a compõem, estando todas direcionadas para um objetivo comum: a satisfação do cliente.
Ementa:
Conceitos e Fundamentos da Garantia da Qualidade: Definição e importância da garantia da qualidade na indústria farmacêutica para assegurar a conformidade dos processos e produtos.
Normas Vigentes para Garantia da Qualidade: Revisão das principais regulamentações que regem a garantia da qualidade, com foco nas diretrizes atuais aplicadas ao setor farmacêutico.
RDC 301/2019 e Garantia da Qualidade: Análise detalhada da RDC 301/2019 e seu impacto nas práticas de garantia da qualidade dentro das empresas farmacêuticas.
Sistema de Qualidade Farmacêutica Q10: Exploração do Sistema de Qualidade Farmacêutica Q10, suas diretrizes e como ele integra as práticas de garantia da qualidade na indústria.
Gestão de Riscos à Qualidade e Pontos Críticos de Controle: Abordagem para identificar e gerenciar riscos à qualidade, incluindo a definição de pontos críticos de controle para mitigar esses riscos.
Implementação da Garantia da Qualidade: Passo a passo para a implementação eficaz de um sistema de garantia da qualidade, alinhado às melhores práticas e normas regulatórias.
Ciclo PDCA e Métodos de Prevenção e Solução de Problemas: Aplicação do ciclo PDCA (Planejar, Fazer, Checar, Agir) e uso de metodologias como MASP, FMEA, FTA e 6 Sigma para melhoria contínua e resolução de problemas.
Técnicas Gerenciais para Garantia da Qualidade: Uso de ferramentas gerenciais como brainstorming, gráfico de Pareto, histograma, gráfico de dispersão, e outras para apoiar a tomada de decisões e o planejamento estratégico na garantia da qualidade.
Carga horária: 10 horas
Descrição:
Este curso detalha as diretrizes ICH Q2(R2) sobre validação de métodos analíticos, ICH Q14 sobre desenvolvimento de métodos analíticos e as melhores práticas de análise crítica e gerenciamento de riscos na indústria farmacêutica. Ao integrar essas normas e ferramentas de gestão, os profissionais serão capacitados a realizar uma análise crítica de dados, identificar pontos de melhoria e gerenciar riscos de forma eficiente, garantindo robustez, precisão e conformidade nos processos analíticos. As aulas ao vivo proporcionarão discussões dinâmicas e aplicações práticas, promovendo um aprendizado alinhado às necessidades reais do setor.
Ementa:
- Introdução ao ICH e Gerenciamento de Risco: Visão geral das diretrizes do ICH e a relevância do gerenciamento de risco para assegurar a qualidade e a segurança dos produtos farmacêuticos.
- ICH Q2(R2) – Validação de Métodos Analíticos: Revisão dos objetivos, escopo e parâmetros de validação, com foco na análise crítica de resultados para garantir a conformidade e robustez dos métodos.
- ICH Q14 – Desenvolvimento de Métodos Analíticos: Abordagem científica e baseada no ciclo de vida para o desenvolvimento de métodos analíticos, com integração de práticas de análise crítica e gerenciamento de risco.
- Análise Crítica de Dados na Validação e Desenvolvimento de Métodos: Técnicas para avaliar criticamente os resultados analíticos, identificar tendências, desvios e áreas de melhoria, promovendo decisões baseadas em evidências.
- Gerenciamento de Risco na Indústria Farmacêutica: Fundamentos e ferramentas para identificar, avaliar e mitigar riscos, incluindo FMEA, HACCP, Ishikawa e outras metodologias aplicadas ao setor farmacêutico.
- Integração de Análise Crítica e Gerenciamento de Riscos: Estruturação de sistemas de qualidade que combinem análise crítica de dados com estratégias de gerenciamento de riscos para criar processos analíticos robustos e confiáveis.
- Estudos de Caso e Aplicações Práticas: Exemplos práticos que demonstram a aplicação de ferramentas de análise crítica e gerenciamento de risco em situações reais de validação e desenvolvimento de métodos.
- Desafios e Melhores Práticas na Implementação: Discussão sobre os principais desafios enfrentados pela indústria farmacêutica e as melhores práticas para implementar análise crítica e gerenciamento de risco de forma eficaz.
Carga horária: 10 horas
Descrição:
O curso tem como objetivo capacitar profissionais para avaliação de risco, execução de testes confirmatórios e controle de nitrosaminas potencialmente carcinogênicas em insumos farmacêuticos ativos (IFA) sintéticos e semi-sintéticos e em medicamentos de uso humano que
as contenham, bem como produtos biológicos, quando cabível. O diferencial do curso é abordar o tema com estudos de caso, possibilitando assim uma visão prática da avaliação de risco de Nitrosaminas e execução de testes confirmatórios conforme preconizado na proposta de legislação da Anvisa em CONSULTA PÚBLICA n° 1050, de 31 de maio de 2021.
Ementa:
Fundamentos sobre Formação de Nitrosaminas: Compreensão dos mecanismos de formação de nitrosaminas em processos farmacêuticos e suas implicações para a segurança do paciente.
RDC 677/2022: Exigências e Limites: Análise das exigências, limites e orientações estabelecidas pela RDC 677/2022 para o controle de nitrosaminas em medicamentos.
Necessidade de Testes Confirmatórios: Identificação de cenários onde é necessário realizar testes confirmatórios para nitrosaminas, garantindo a conformidade com as normas regulatórias.
Métodos Gerais para Detecção de Nitrosaminas: Exploração do capítulo geral da USP <1469> que trata de impurezas de nitrosaminas, incluindo técnicas recomendadas para sua detecção e quantificação.
Definição de Limites e Especificações: Estabelecimento de limites e especificações para nitrosaminas clássicas e não clássicas, com base em diretrizes toxicológicas e regulatórias.
Avaliação Toxicológica de Nitrosaminas: Abordagem para a avaliação toxicológica de nitrosaminas, considerando os potenciais riscos à saúde e a segurança dos medicamentos.
Desenho Experimental e Plano de Estudo: Desenvolvimento de um plano de estudo e desenho experimental robusto para a avaliação de nitrosaminas em produtos farmacêuticos.
Validação Analítica e Elaboração de Relatório de Risco: Parâmetros requeridos para a validação analítica de métodos que detectam nitrosaminas e a elaboração de um modelo de relatório de avaliação de risco, conforme a fase 2 das diretrizes.
Carga horária: 10 horas
Descrição:
O Estudo de Extraíveis e Lixiviáveis é fundamental para que se estabeleça a embalagem a ser utilizada, garantindo que o medicamento permaneça em perfeitas condições quanto à sua estabilidade e substâncias que possam migrar da embalagem pro medicamento durante todo o tempo de vida do mesmo.
Ementa:
Conceito de Compostos Extraíveis e Lixiviáveis: Definição e importância dos compostos extraíveis e lixiviáveis no contexto da segurança de produtos farmacêuticos e dispositivos médicos.
Normas Vigentes: Quando, Por Que e Como Realizar Estudos: Análise das diretrizes regulatórias, explicando por que, quando e como conduzir estudos de extraíveis e lixiviáveis, com foco nas normas vigentes.
Avaliação de Risco para Lixiviáveis: Metodologia para a avaliação de risco associada aos lixiviáveis, considerando a potencial migração de compostos para o produto final.
Estudo de Extraíveis e Identificação de Lixiviáveis: Planejamento e execução de estudos para identificar possíveis lixiviáveis a partir dos materiais de embalagem ou contato.
Técnicas Analíticas Principais: Revisão das principais técnicas analíticas utilizadas para a detecção e quantificação de compostos extraíveis e lixiviáveis.
Comparação e Análise dos Estudos: Métodos para comparar os resultados de estudos de extraíveis e lixiviáveis, garantindo a consistência e a segurança dos dados obtidos.
Quantificação de Lixiviáveis e Tomada de Decisão: Abordagem para a quantificação de lixiviáveis identificados e as decisões subsequentes, incluindo a troca de embalagem ou a avaliação toxicológica dos compostos.
Gestão de Resultados e Implementação de Ações Corretivas: Estruturação do processo de decisão após a identificação de lixiviáveis, como a troca de embalagem ou medidas para mitigar riscos toxicológicos.
Carga horária: 15 horas
Gravação em Aula Ao Vivo agendada Novembro/2024
Descrição:
Este curso aborda a relação entre as legislações internacionais e nacionais aplicáveis à indústria farmacêutica, destacando as diretrizes do ICH (International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use) e as RDCs (Resoluções da Diretoria Colegiada) da ANVISA. Compreender essas regulamentações é essencial para assegurar a conformidade, a qualidade e a segurança dos produtos farmacêuticos. As aulas ao vivo permitirão uma interação dinâmica e esclarecedora sobre os principais desafios e melhores práticas na aplicação dessas normas.
Ementa:
Introdução às Legislações Internacionais e Nacionais: Contextualização das regulamentações farmacêuticas, destacando a importância das diretrizes do ICH e das RDCs da ANVISA.
Estrutura e Objetivos do ICH: Exploração da história, formação e principais diretrizes do ICH, como estabilidade (Q1), validação de métodos analíticos (Q2), e gestão de qualidade (Q9).
Principais Diretrizes do ICH: Revisão das diretrizes-chave do ICH, incluindo práticas de fabricação, desenvolvimento farmacêutico, e especificações técnicas.
RDCs da ANVISA e sua Aplicabilidade: Análise da estrutura e função das RDCs, com foco nas principais regulamentações que afetam a indústria farmacêutica brasileira.
Comparação entre ICHs e RDCs: Estudo da harmonização e comparação das diretrizes do ICH com as RDCs correspondentes, e o impacto dessa harmonização na indústria farmacêutica no Brasil.
Aplicação Prática e Estudos de Caso: Exemplos práticos demonstrando a implementação das diretrizes do ICH e RDCs, discutindo desafios comuns e soluções práticas.
Atualizações e Futuras Diretrizes: Discussão sobre as últimas novidades e tendências nas regulamentações internacionais e nacionais, com previsões para futuras diretrizes e seu impacto.
Discussão e Interação com os Participantes: Sessão interativa para responder perguntas, discutir temas relevantes e abordar dúvidas dos participantes sobre as regulamentações.
Carga horária: 10 horas
Aulas ao Vivo no Zoom:
- 27/07/2024 + 03/08/2024 + gravação na íntegra
Gravação em Aula Ao Vivo agendada Primeiro Semestre de 2025.
Descrição:
Este curso abrange os princípios e práticas da documentação técnica na área analítica da indústria farmacêutica. A documentação bem estruturada e conforme as regulamentações é essencial para garantir a qualidade, rastreabilidade e conformidade dos processos analíticos. O curso abordará desde a criação de protocolos e relatórios até a manutenção de registros e auditorias. As aulas ao vivo permitirão uma compreensão prática e detalhada das exigências documentais e das melhores práticas de escrita técnica.
Ementa:
Importância e Tipos de Documentação Técnica: Exploração da importância da documentação técnica na indústria farmacêutica, incluindo os diferentes tipos de documentos e suas funções essenciais para a conformidade regulatória.
Regulamentações e Normas Vigentes: Revisão das principais regulamentações nacionais e internacionais (ANVISA, ICH, FDA, EMA) que regem a documentação técnica, com foco nos requisitos documentais e boas práticas de documentação.
Protocolos e Relatórios de Validação Analítica: Estruturação e conteúdo dos protocolos de validação analítica, além do desenvolvimento e redação de relatórios, com exemplos práticos e estudos de caso.
Registros de Análises e Conformidade com BPL: Técnicas de manutenção de registros de laboratório e documentação de resultados analíticos, garantindo a conformidade com as Boas Práticas de Laboratório (BPL).
Desenvolvimento e Implementação de POPs: Criação, estruturação e implementação de Procedimentos Operacionais Padrão (POP), incluindo treinamento, controle de mudanças e atualizações.
Documentação de Estudos de Estabilidade: Planejamento, execução e documentação de estudos de estabilidade, com ênfase na redação de protocolos, relatórios e interpretação de dados.
Gerenciamento de Documentos e Auditorias: Implementação de sistemas de gerenciamento documental, armazenamento, recuperação de documentos e preparação para auditorias internas e externas.
Escrita Técnica e Integração com Sistemas de Qualidade: Princípios de escrita técnica clara e concisa, revisão e edição de documentos, e a integração eficaz da documentação com o sistema de qualidade para suporte em auditorias e inspeções.
Carga Horária: 12 horas
Aulas ao Vivo no Zoom:
- Datas a definir
Gravação em Aula Ao Vivo agendada Primeiro Semestre de 2025.
Descrição:
Este curso oferece uma visão abrangente dos assuntos regulatórios na indústria farmacêutica, com um foco especial na relação com a documentação técnica. Os profissionais aprenderão sobre as principais regulamentações nacionais e internacionais, o processo de submissão de documentos regulatórios e como garantir a conformidade com as exigências das agências reguladoras. As aulas ao vivo proporcionarão uma compreensão detalhada dos requisitos regulatórios e das melhores práticas de preparação e manutenção de documentação técnica.
Ementa:
Introdução aos Assuntos Regulatórios e Agências Principais: Definição e importância dos assuntos regulatórios na indústria farmacêutica, com destaque para as principais agências reguladoras como ANVISA, FDA e EMA.
Regulamentações Nacionais e Internacionais: Visão geral das regulamentações nacionais (ANVISA) e internacionais (ICH, FDA, EMA), explorando as principais diferenças e semelhanças entre elas.
Processo de Submissão Regulatória: Tipos de submissões regulatórias (IND, NDA, ANDA, BLA, CTD) e as etapas do processo, desde a preparação até o acompanhamento pós-submissão, com exemplos de casos bem-sucedidos.
Documentação Técnica para Submissões Regulatórias: Relação entre a documentação técnica e os requisitos regulatórios, incluindo relatórios de validação, POPs, e estudos de estabilidade, com ênfase em boas práticas de documentação.
Desenvolvimento, Manutenção e Auditoria de Documentação: Estruturação, redação e manutenção de documentos técnicos, incluindo controle de mudanças e conformidade regulatória durante auditorias internas.
Avaliação e Gerenciamento de Riscos na Submissão Regulatória: Princípios e ferramentas para a avaliação e mitigação de riscos durante o processo de submissão, com integração ao gerenciamento de riscos na documentação técnica.
Interação com Agências Reguladoras: Melhores práticas para comunicação e negociação com agências reguladoras, incluindo resposta a consultas e deficiências regulatórias.
Casos Práticos e Discussão de Atualizações Regulatórias: Análise de desafios regulatórios reais e soluções aplicadas, com discussões sobre as últimas tendências e previsões para futuras diretrizes regulatórias.
Carga horária: 15 horas
Aulas ao vivo no Zoom:
- 28/09/2024 + 05/10/2024 + gravação na íntegra
Descrição:
O curso aborda a importância do autoconhecimento e da ciência da personalidade como ferramentas para o desenvolvimento profissional e o fortalecimento de equipes na indústria farmacêutica. Com base em teorias científicas e práticas comportamentais, os participantes aprenderão a identificar seus próprios traços de personalidade, compreender os dos colegas de trabalho e aplicar esse conhecimento na resolução de conflitos, no aumento da produtividade e na melhoria da comunicação dentro de suas equipes. Além disso, o curso integra essas habilidades aos desafios específicos do setor farmacêutico, promovendo ambientes de trabalho mais colaborativos e eficazes.
Ementa:
- Fundamentos da Ciência da Personalidade: Introdução às teorias científicas da personalidade, como o Big Five, e sua relevância para o desenvolvimento pessoal e profissional na indústria farmacêutica.
- Autoconhecimento e Autorregulação: Técnicas para identificar traços pessoais de comportamento e estratégias para gerenciar emoções, melhorar o foco e aumentar a resiliência.
- Personalidade e Comunicação no Ambiente Farmacêutico: Análise de como diferentes traços de personalidade influenciam a comunicação e o trabalho em equipe em ambientes altamente regulados e orientados por resultados.
- Gestão de Conflitos e Tomada de Decisões: Ferramentas para lidar com conflitos no local de trabalho e aprimorar a capacidade de tomar decisões assertivas, mesmo sob pressão.
- Desenvolvimento de Liderança e Empatia: Abordagem para identificar e desenvolver habilidades de liderança baseadas na empatia, adaptando-se às necessidades específicas da equipe e da organização.
- Ciência da Personalidade e Neuroquímica do Comportamento: Exploração das bases neuroquímicas que sustentam traços de personalidade e comportamentos, conectando ciência à prática no setor farmacêutico.
- Dinâmicas de Grupo e Fortalecimento de Equipes: Atividades práticas para promover a coesão da equipe, aumentar a confiança mútua e melhorar a produtividade em projetos colaborativos.
Carga horária: X horas
CURSO EM CONSTRUÇÃO
CURSO EM CONSTRUÇÃO
CURSO EM CONSTRUÇÃO
CURSO EM CONSTRUÇÃO
Períodos de Acesso
1 mês
Todos os cursos liberados durante 30 dias, com renovação opcional.
6 meses
Todos os cursos liberados durante 6 meses, com renovação opcional.
12 meses
Todos os cursos liberados durante 12 meses, com renovação opcional.
Benefícios
+400 horas
Cerca de 400 horas de vídeo aulas com material em PDF e certificado pela plataforma
Afiliados
Como aluno, você pode ganhar até 50% de comissão indicando a Plataforma EAD da Cienco
Indica-FARMA
Projeto de indicação da Cienco, conectando os você aos grandes laboratórios
Parcelado
Pagamento parcelado no cartão de crédito em 6x (semestral) ou 12x (anual)
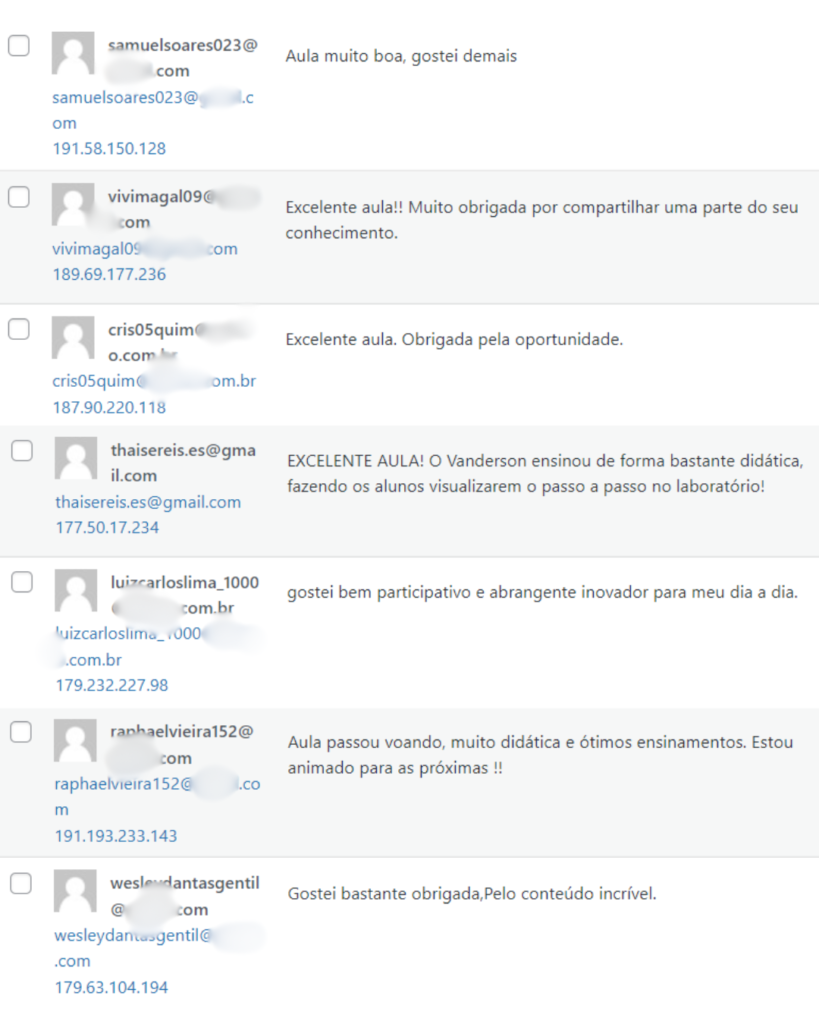
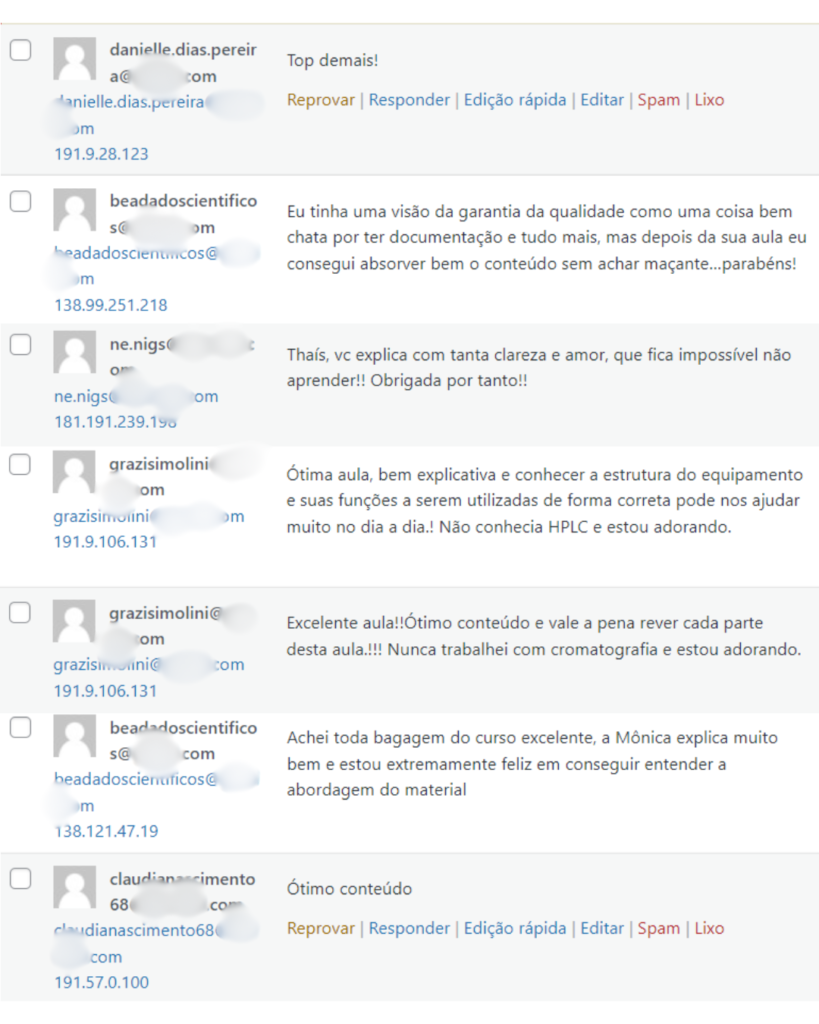
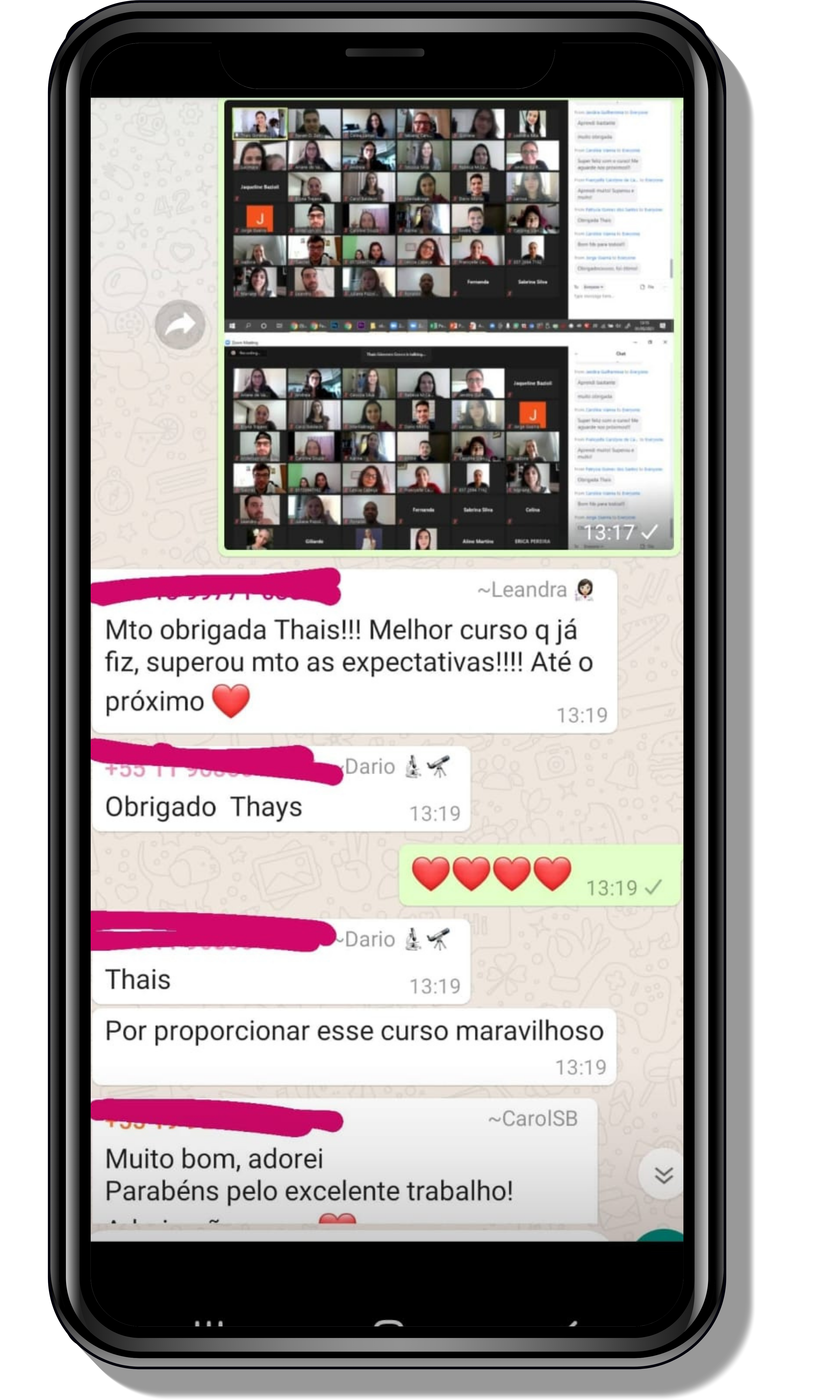
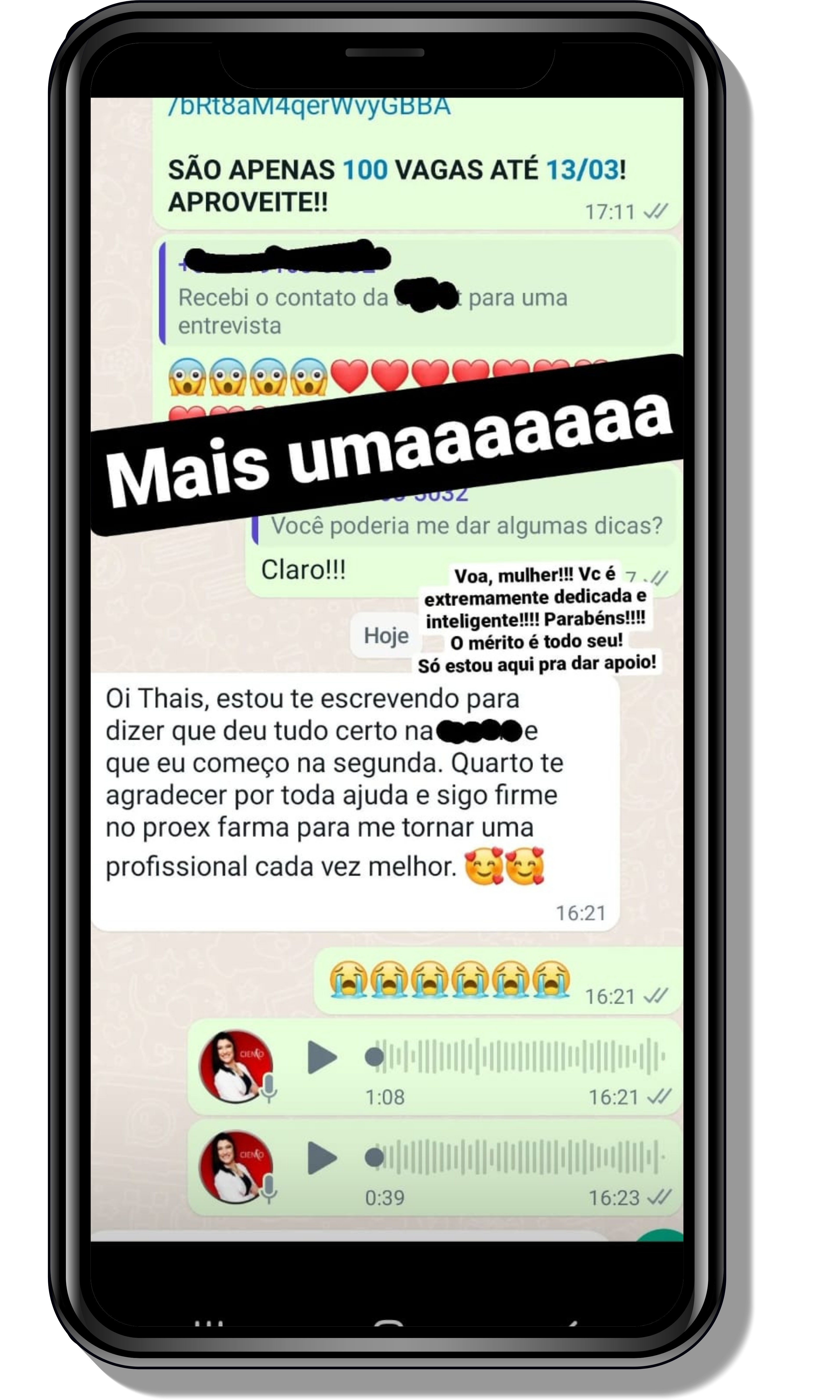
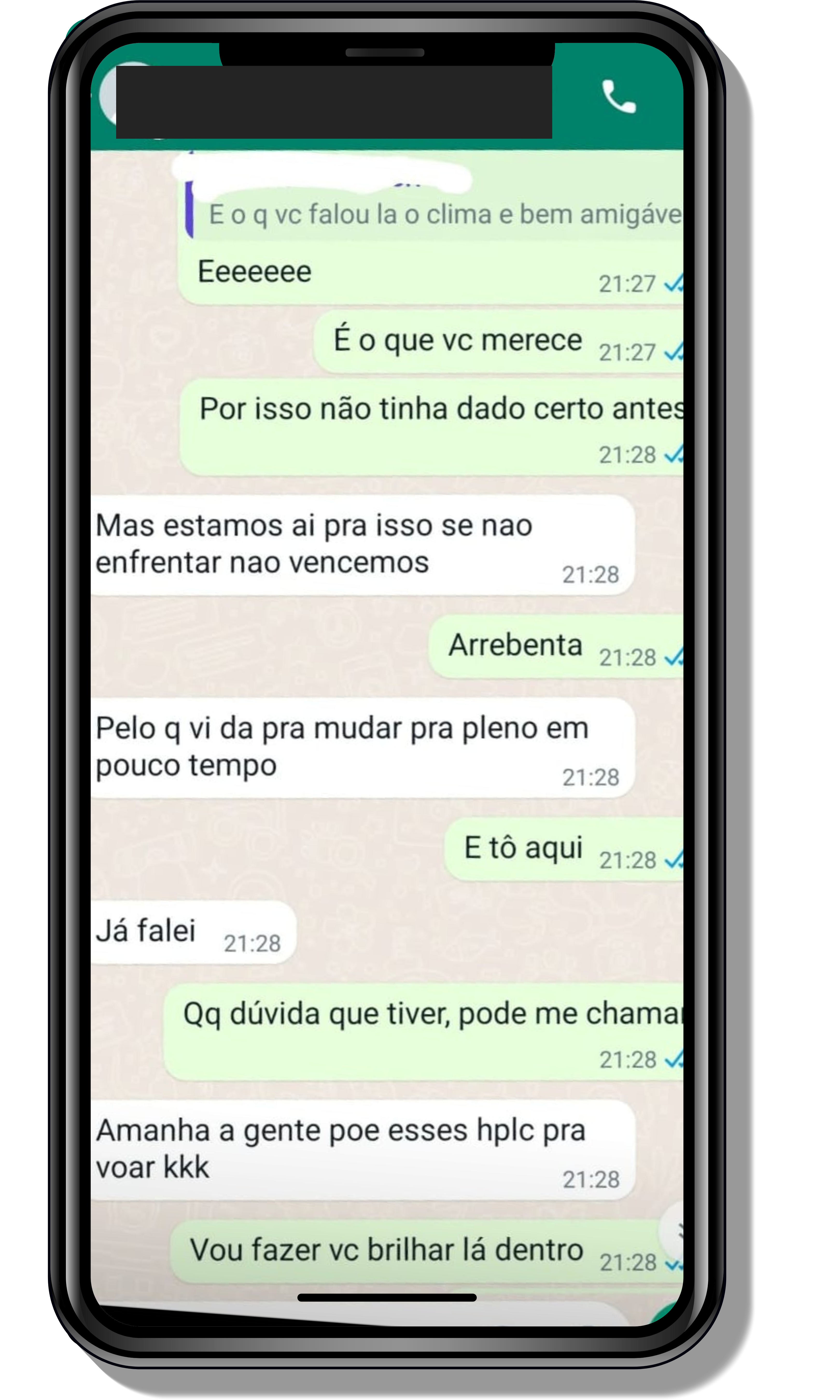
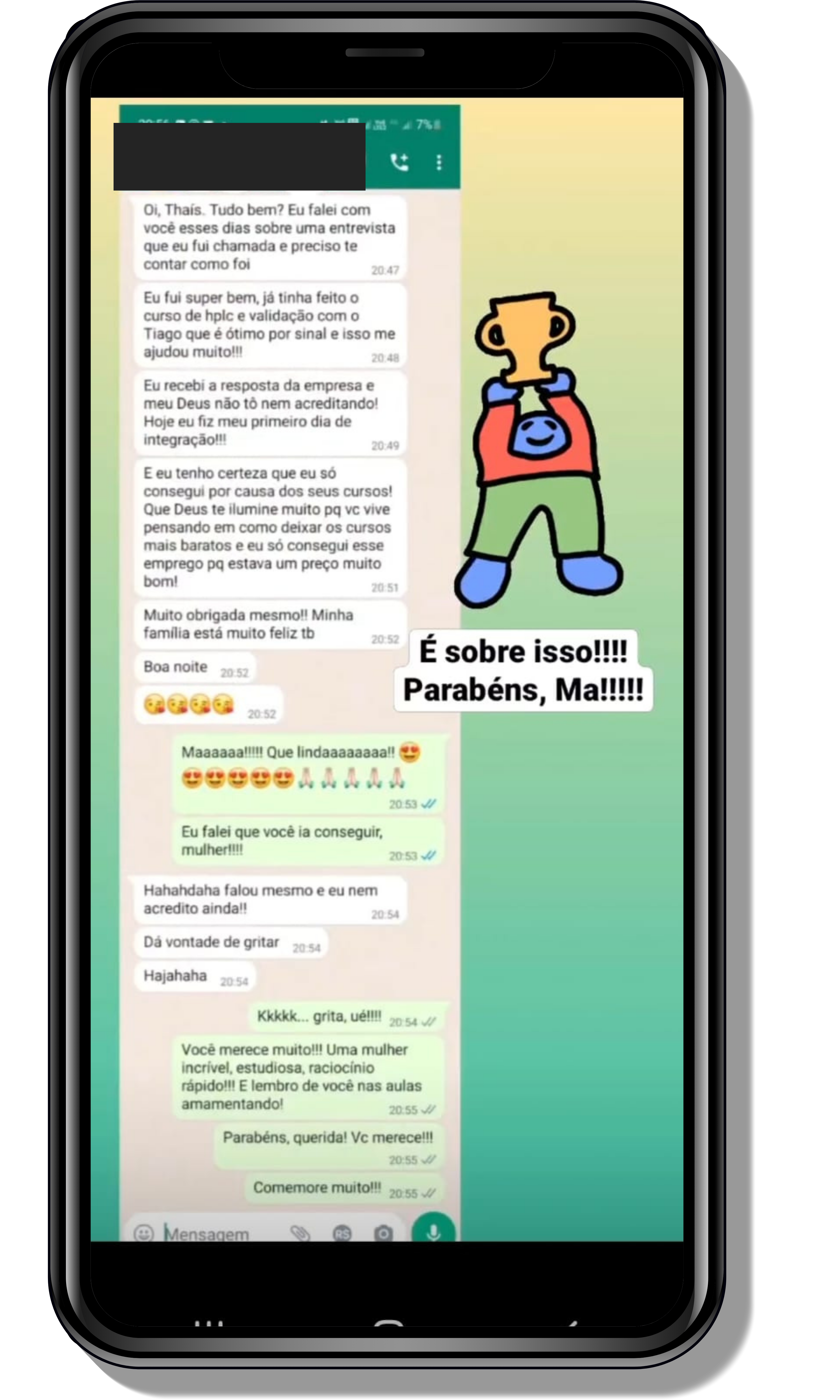
Veja o que os alunos estão achando dos programas de cursos e mentorias da Cienco
P-EAD CIENCO
1 mês
R$ 700,00
VALOR MÉDIO MENSAL:
R$ 700,00
Todos os cursos liberados durante 30 dias, com renovação opcional.
–
–
6 meses
R$ 3.000,00
VALOR MÉDIO MENSAL:
R$ 500,00 (-30%)
Todos os cursos liberados durante 6 meses, com renovação opcional.
BÔNUS: +3 MESES DE CORTESIA NO PAGAMENTO À VISTA
12 meses
R$ 5.000,00
VALOR MÉDIO MENSAL:
R$ 416,67(-40%)
Todos os cursos liberados durante 12 meses, com renovação opcional.
BÔNUS: +6 MESES DE CORTESIA NO PAGAMENTO À VISTA

Pergutas Frequentes
Você terá acessos a todos os cursos pelo período que fizer a contratação, podendo renovar ao final de cada ciclo contratado pelo mesmo valor ou migrar para um outro período.
Sim. Os cursos são totalmente livres pra você assistir e rever quantas vezes e quando você quiser.
Sim. Todos os módulos são cursos nos quais você poderá emitir o certificado direto pela Plataforma EAD da Cienco, com código de autenticidade.
Imeditamente após o pagamento ou agendamento da primeira parcela você já terá acesso aos cursos pela Plataforma EAD da Cienco.
Sim, totalmente online, com muita informação teórica e orientações práticas de como elaborar seu procedimento experimental no laboratório analítico.
Sim. Assim como também funciona para quem já é mais experiente e precisa se atualizar.
Nós oferecemos uma lista de exercícios como sugestão. Não é obrigatório fazer a lista, mas é indicado pra que você possa treinar e se preparar melhor para os processos seletivos, entrevistas e seu primeiro ano como analista JR na indústria farmacêutica.
A Plataforma EAD da Cienco respeita o seu ritmo, é totalmente flexível, encaixando-se exatamente na sua necessidade.
Oriento a reservar pelo menos 1h 3 a 4x por semana ou 4 horas contínuas por semana, assistindo os cursos com calma e muita concentração por pelo menos 2x.
A velocidade e qualidade dos seus resultados será totalmente dependente do seu comprometimento.
Por isso, enfatizo aqui que este não é um programa para profissionais medianos. Aqui é lugar para profissionais realmente comprometidos, que sabem que para estar entre os melhores, nos cargos mais altos, é preciso, sim, se dedicar, investir tempo, recursos e energia.
Com certeza! E neste caso, oferecemos um serviço complementar para o gestor, com apresentação de relatório de aproveitamento das aulas pelos alunos.
Lembrando que, neste caso, a vaga é DA EMPRESA, podendo esta trocar por outro analista caso haja a necessidade.
Emitimos, sim. E pode ser feita de várias maneiras:
- contratação pela empresa com NF com o CNPJ da empresa: recebemos direto da empresa e você não paga nada.
- contratação inicial por você (você paga pra gente), emitimos a NF para a empresa e, ao receber, estornamos o valor que você nos pagou.
- contratação inicial por você (você paga pra gente), emitimos a NF no seu CPF e você recebe o valor direto da sua empresa.
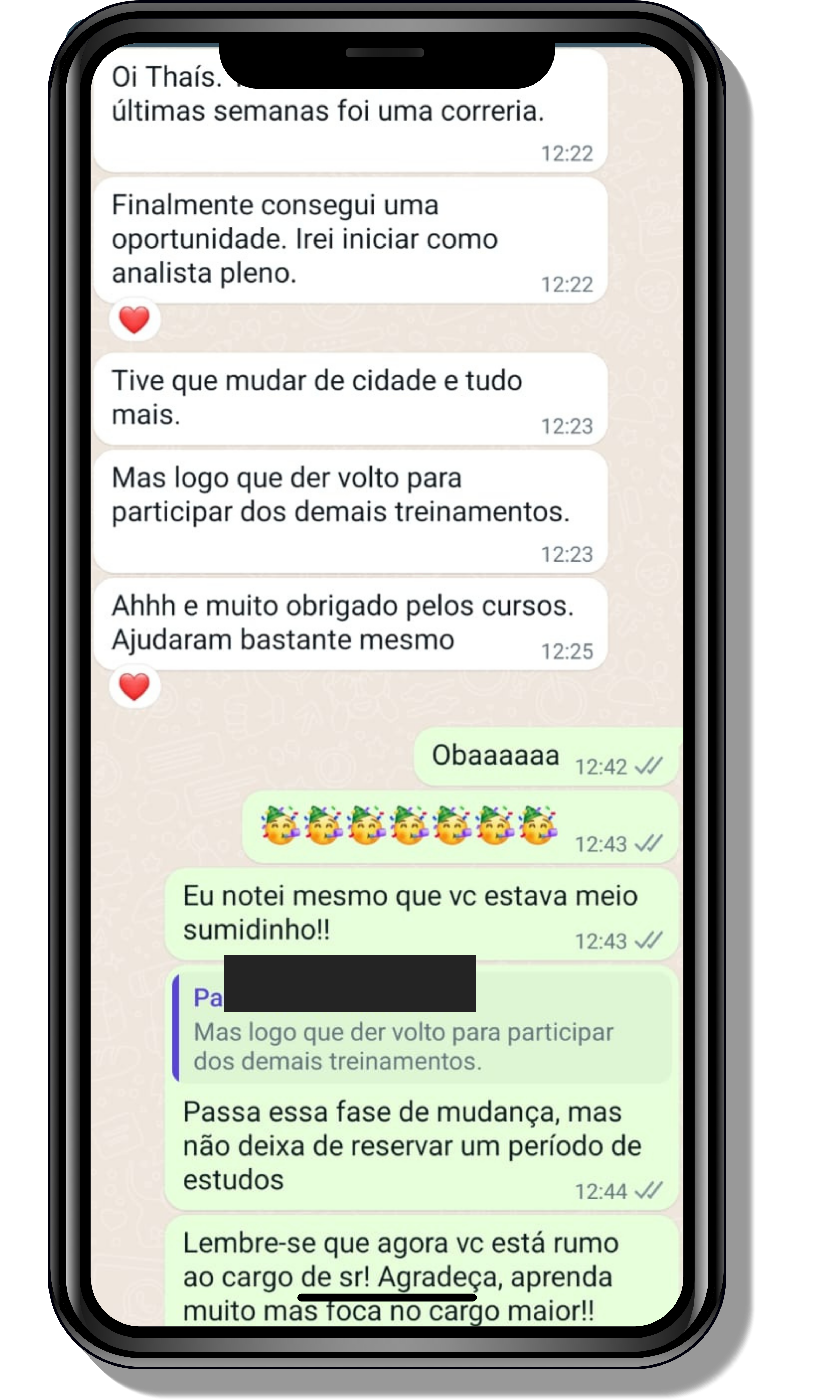
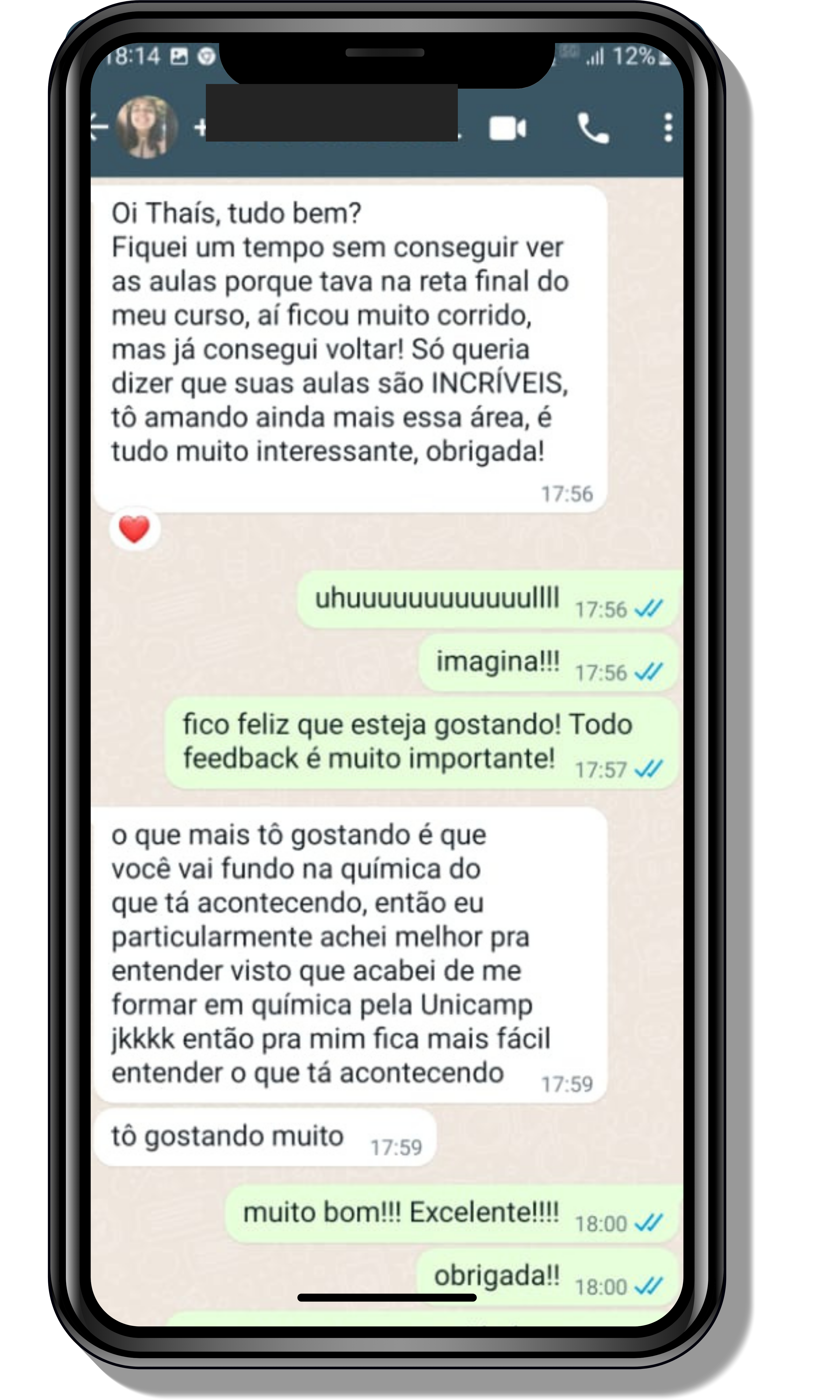
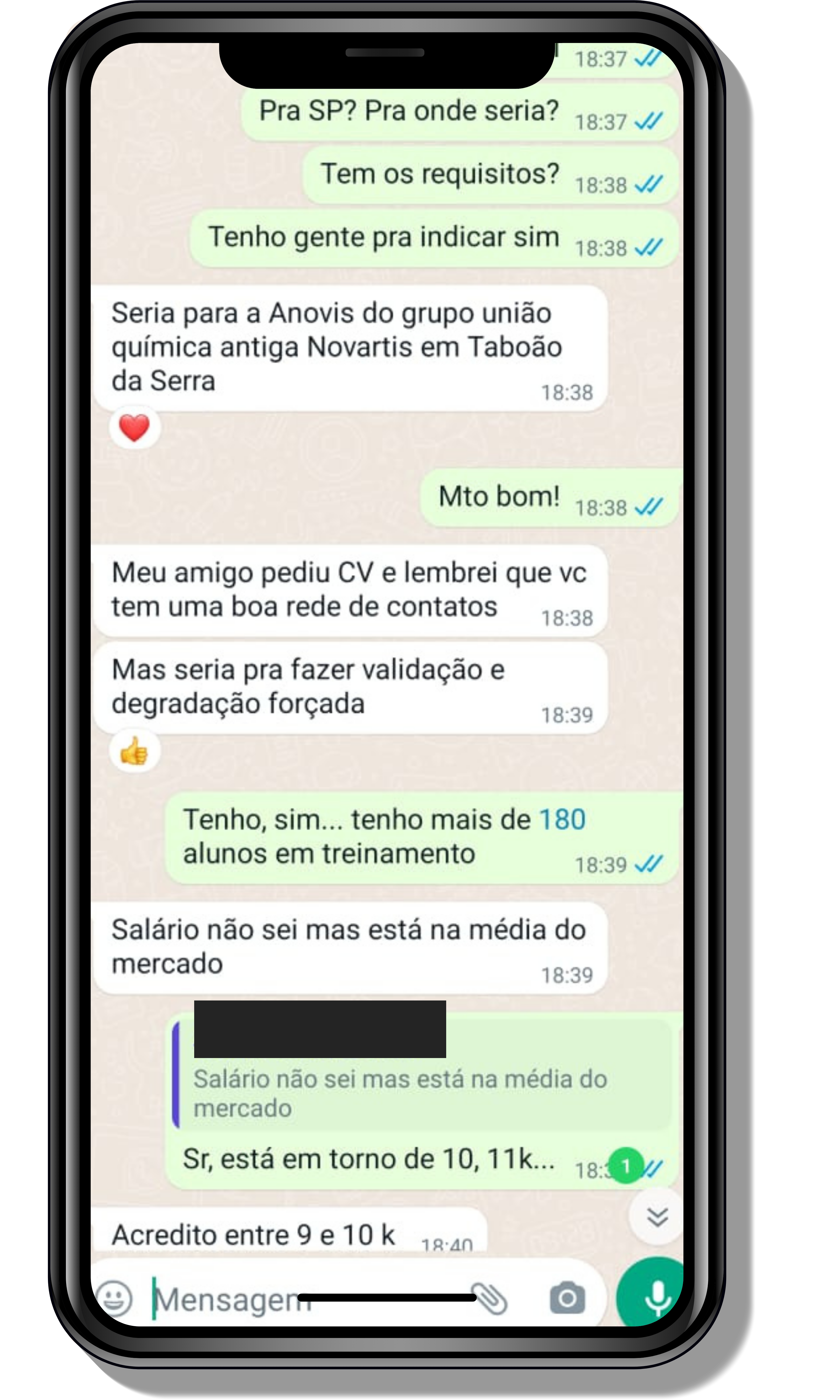
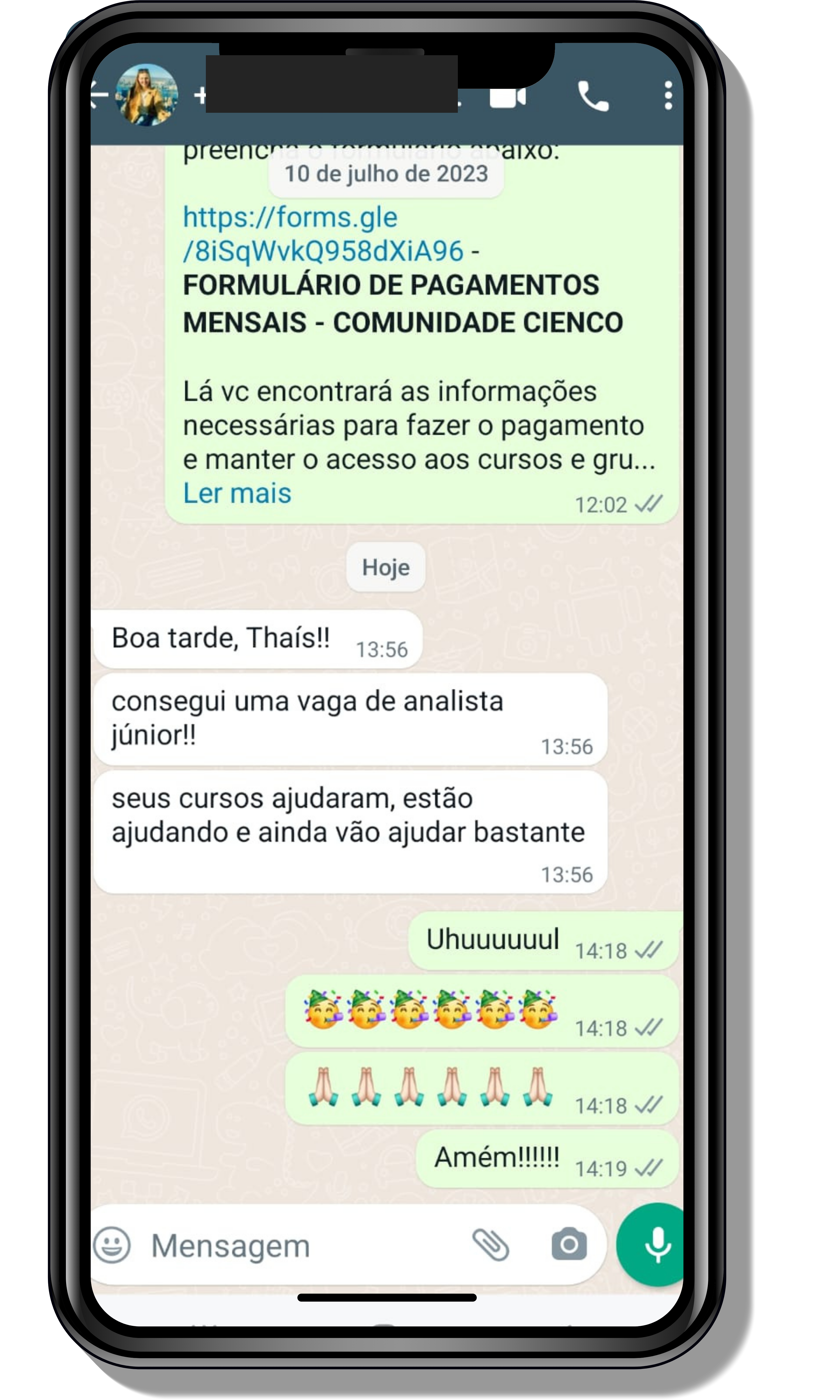
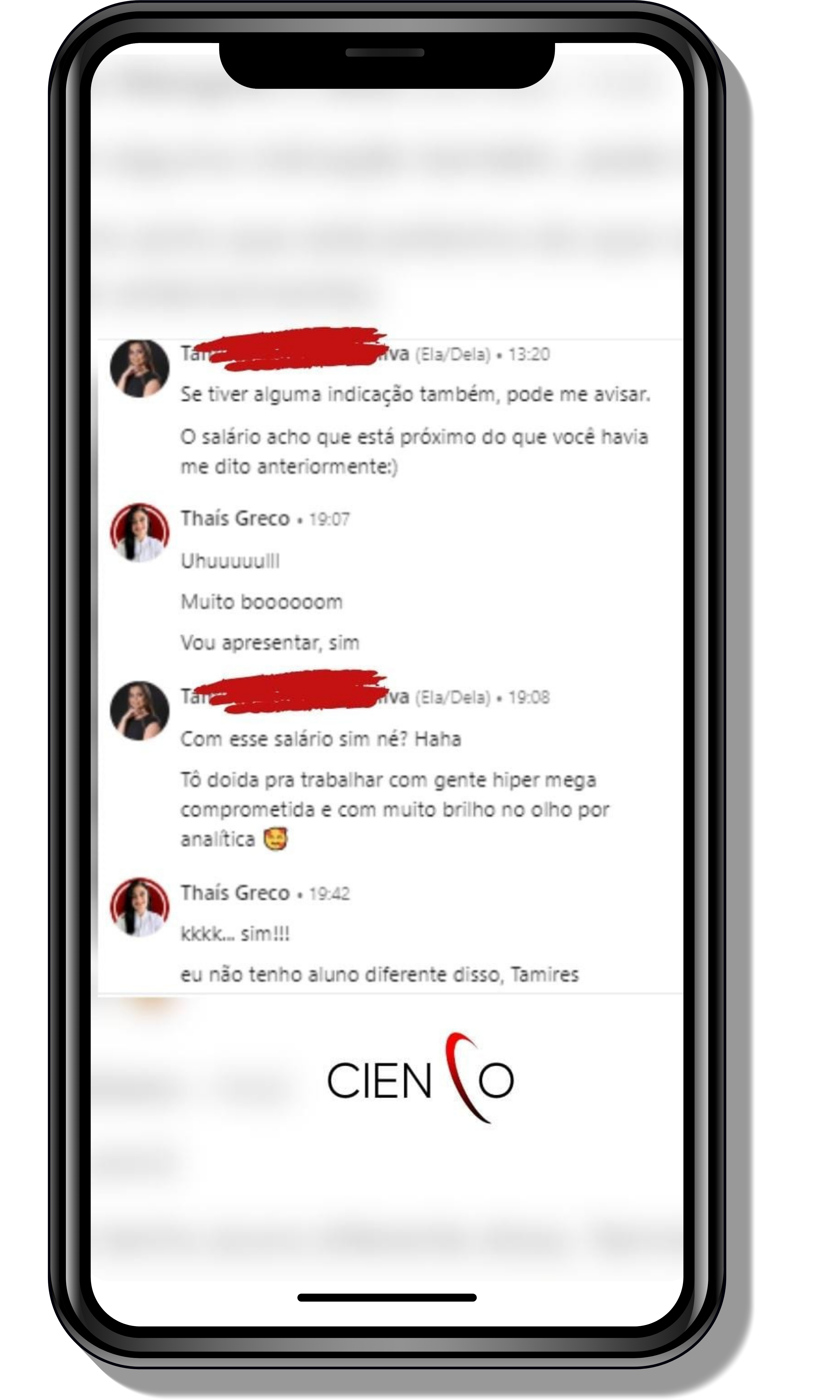
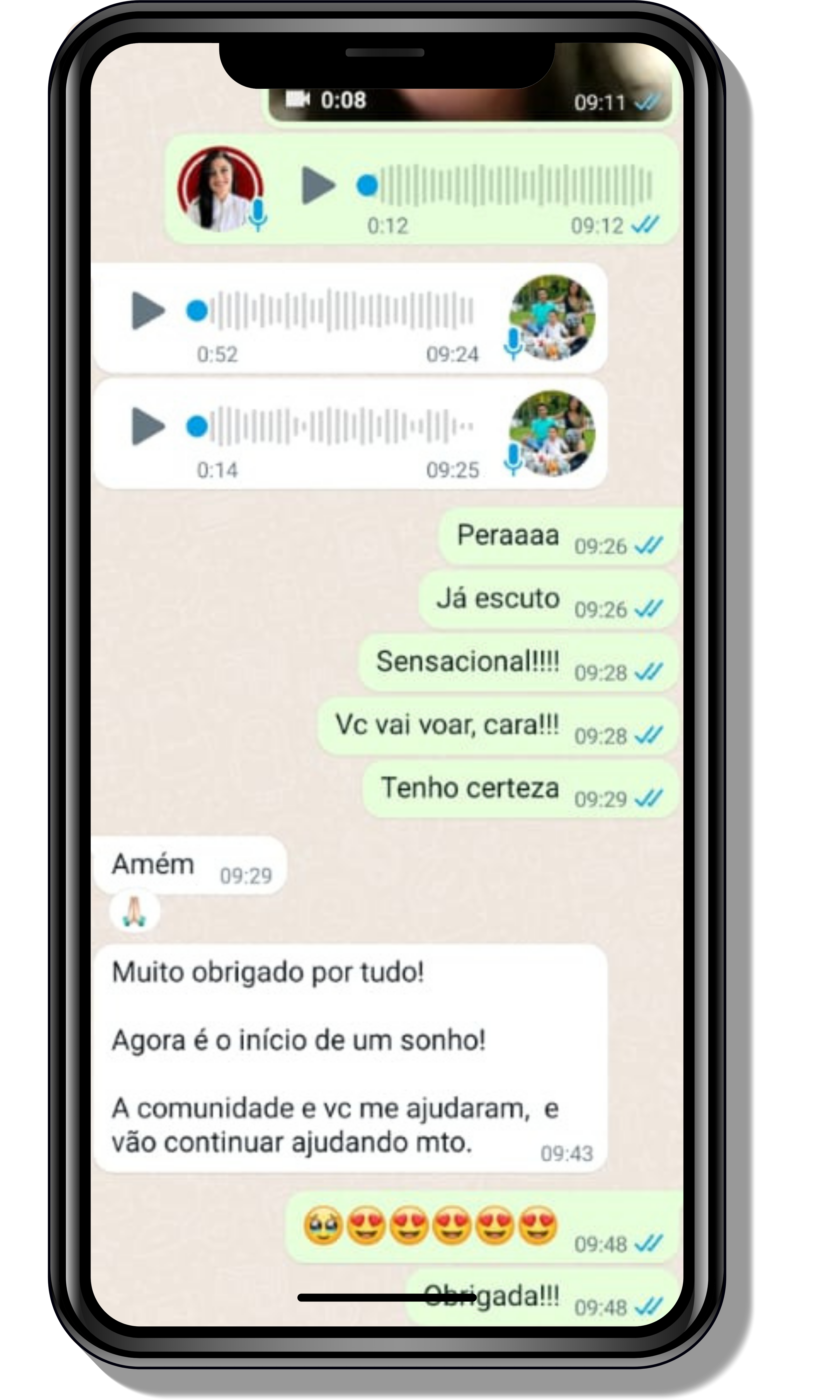
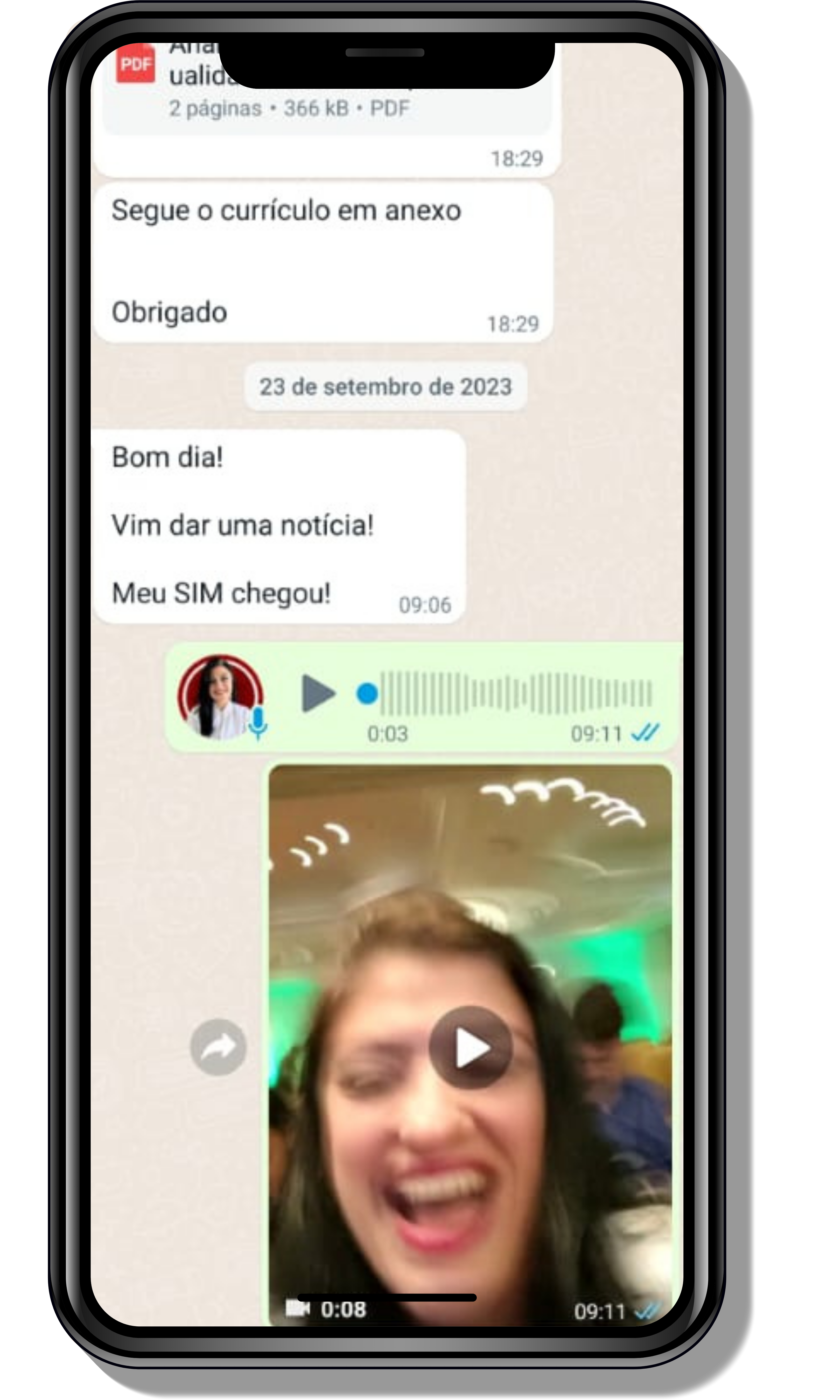
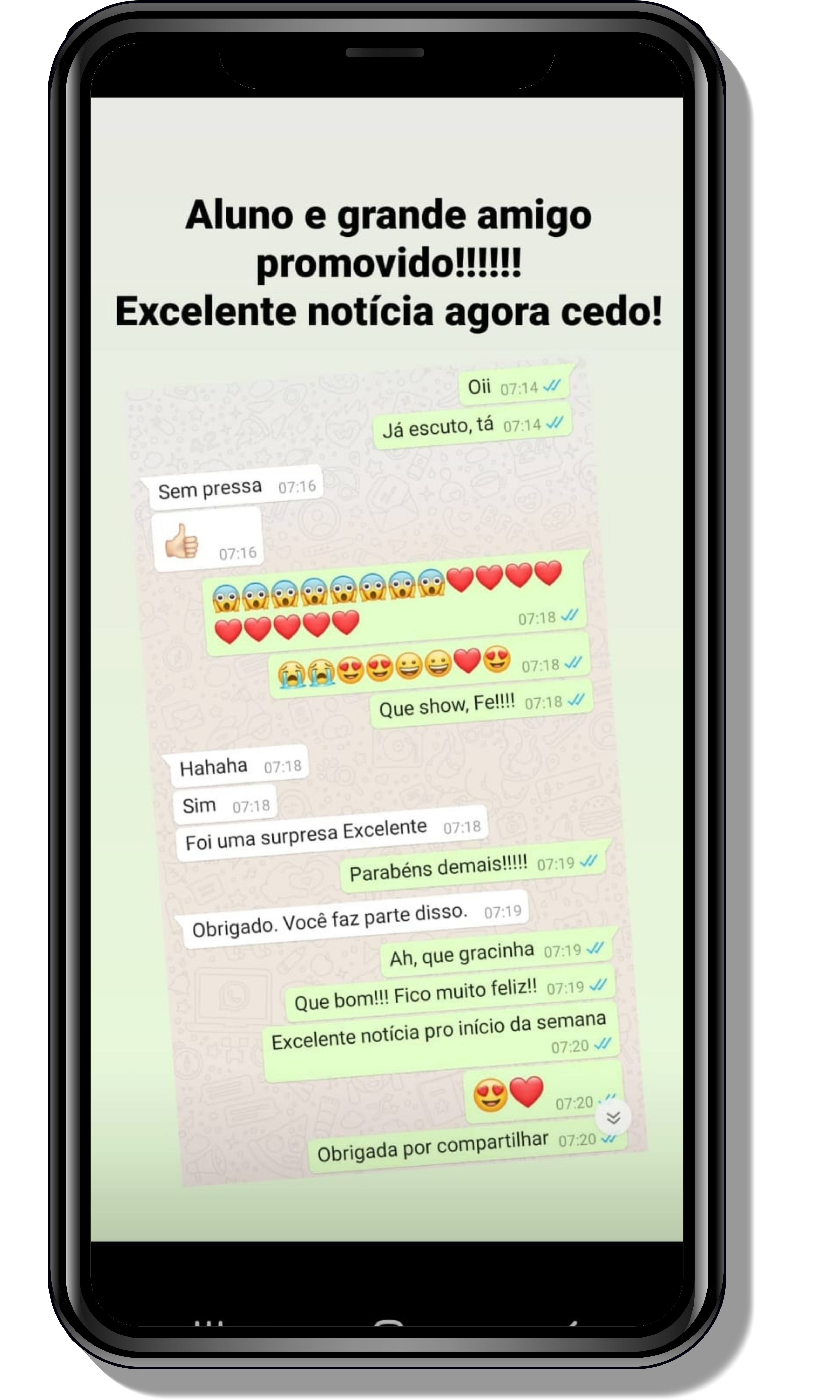
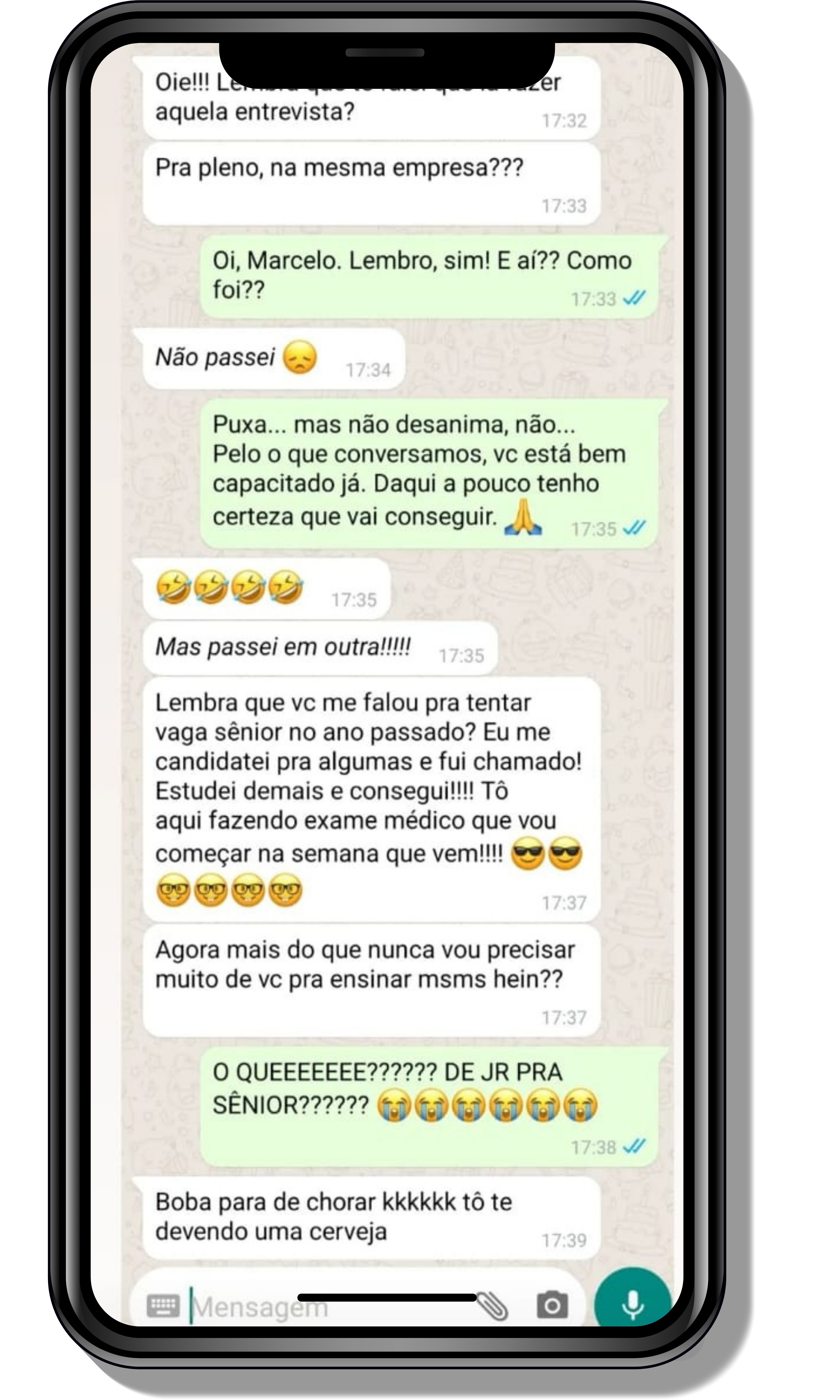
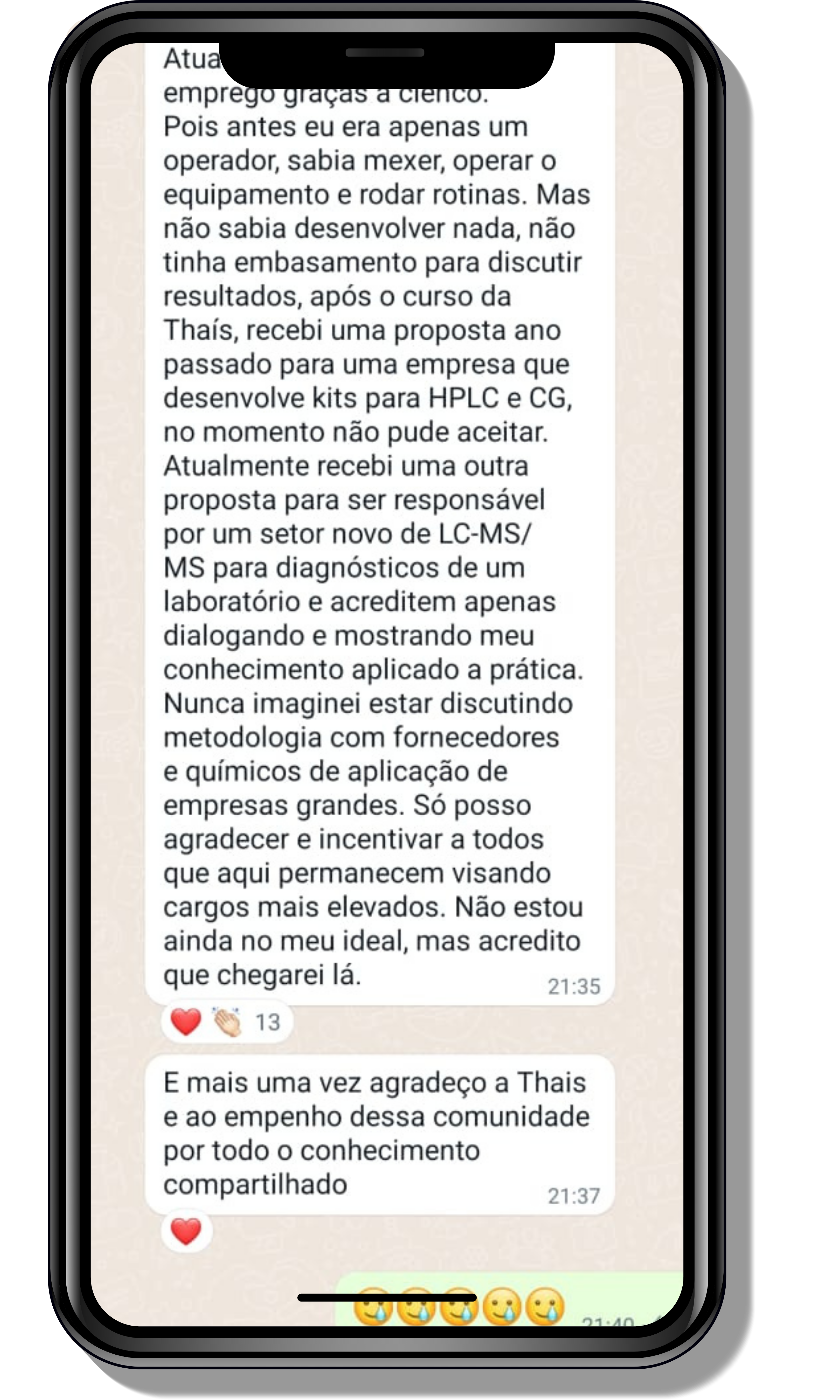
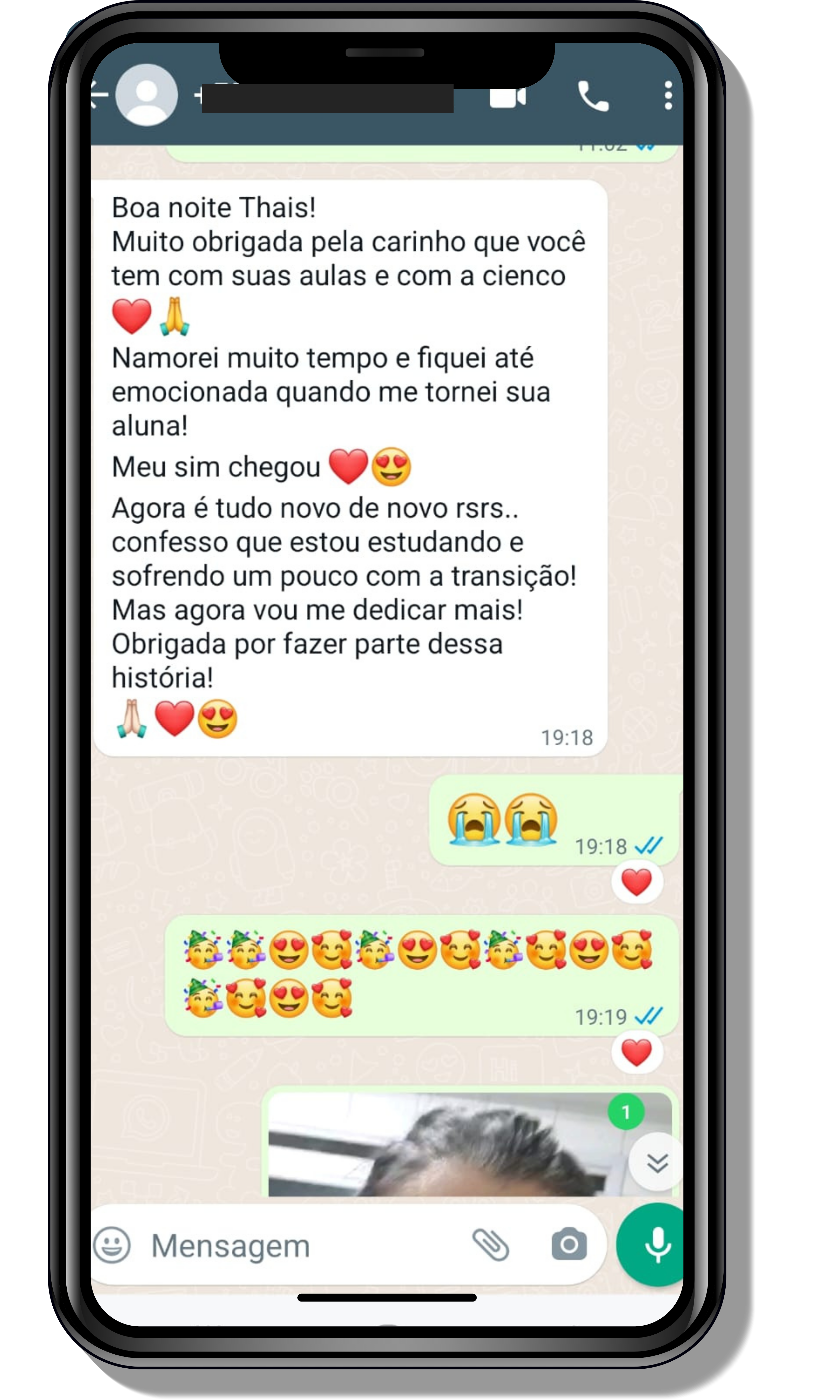
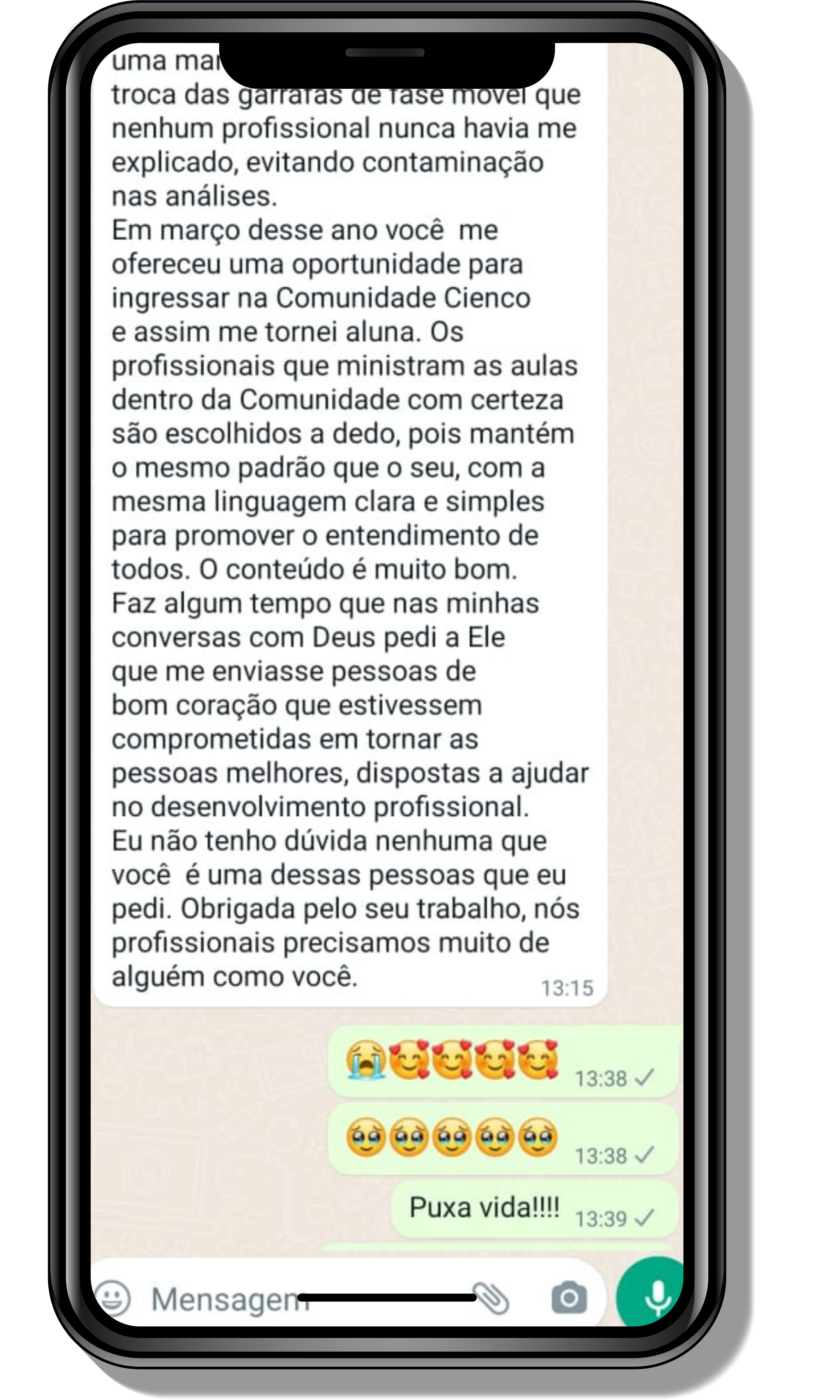
Seja você o próximo aluno a me mandar mensagens como essas!
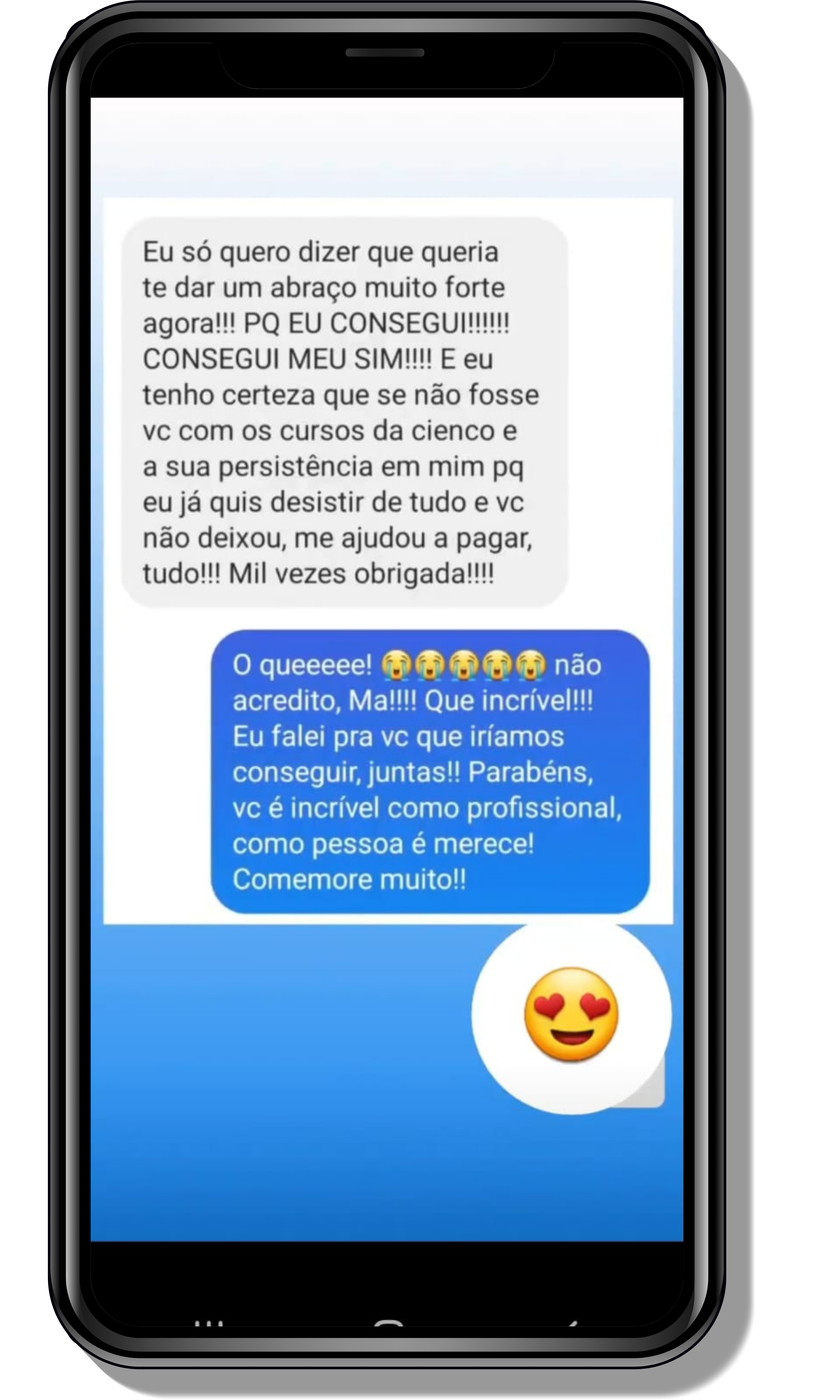
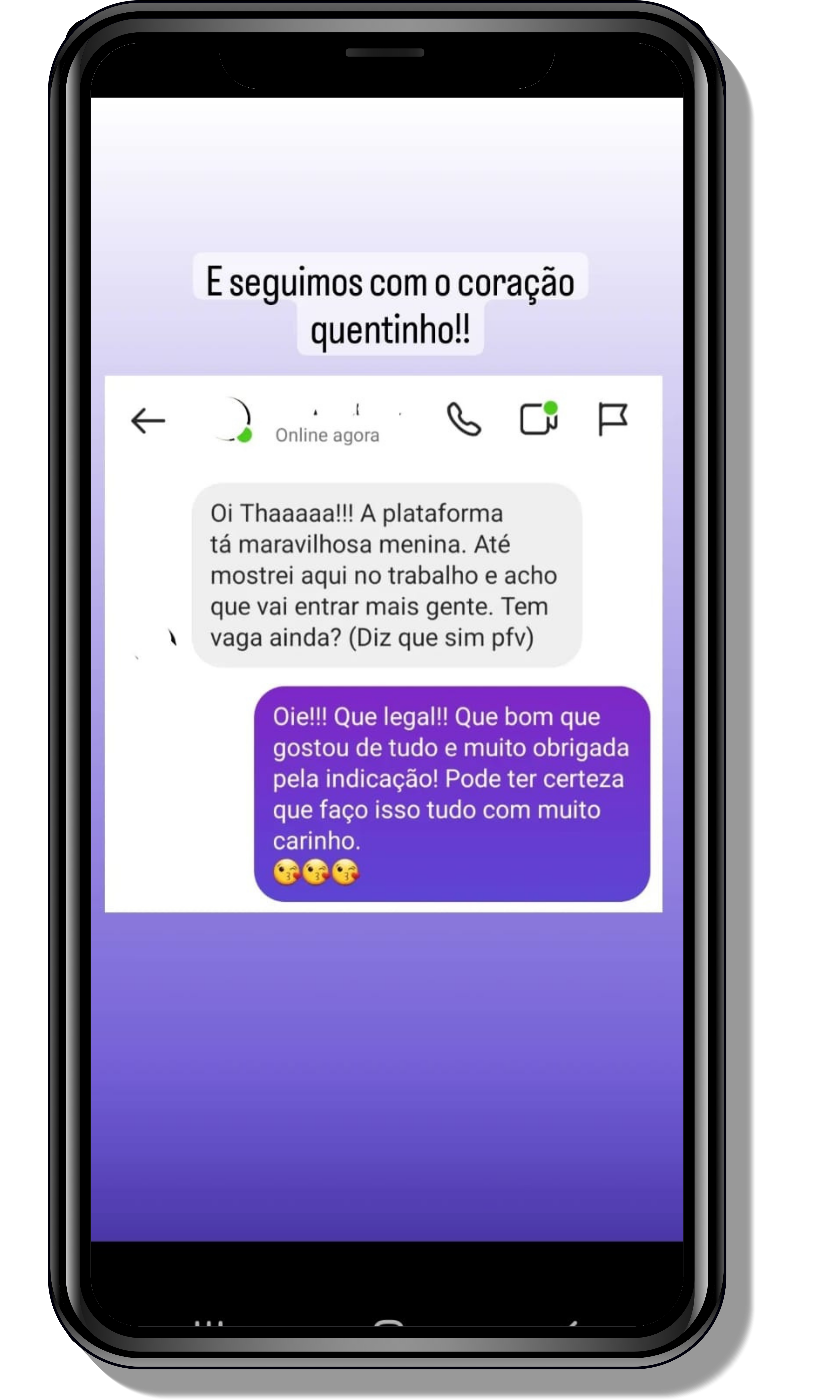
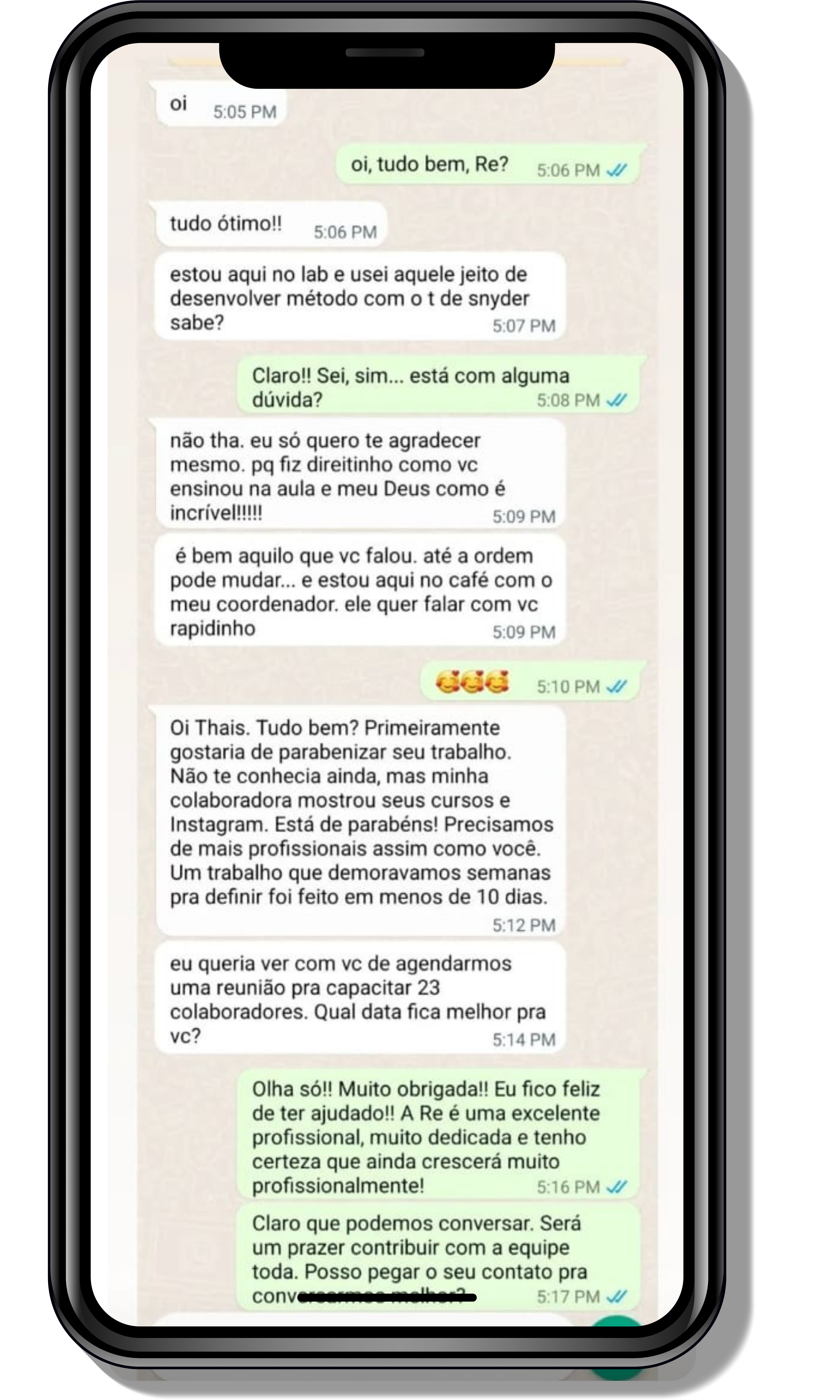
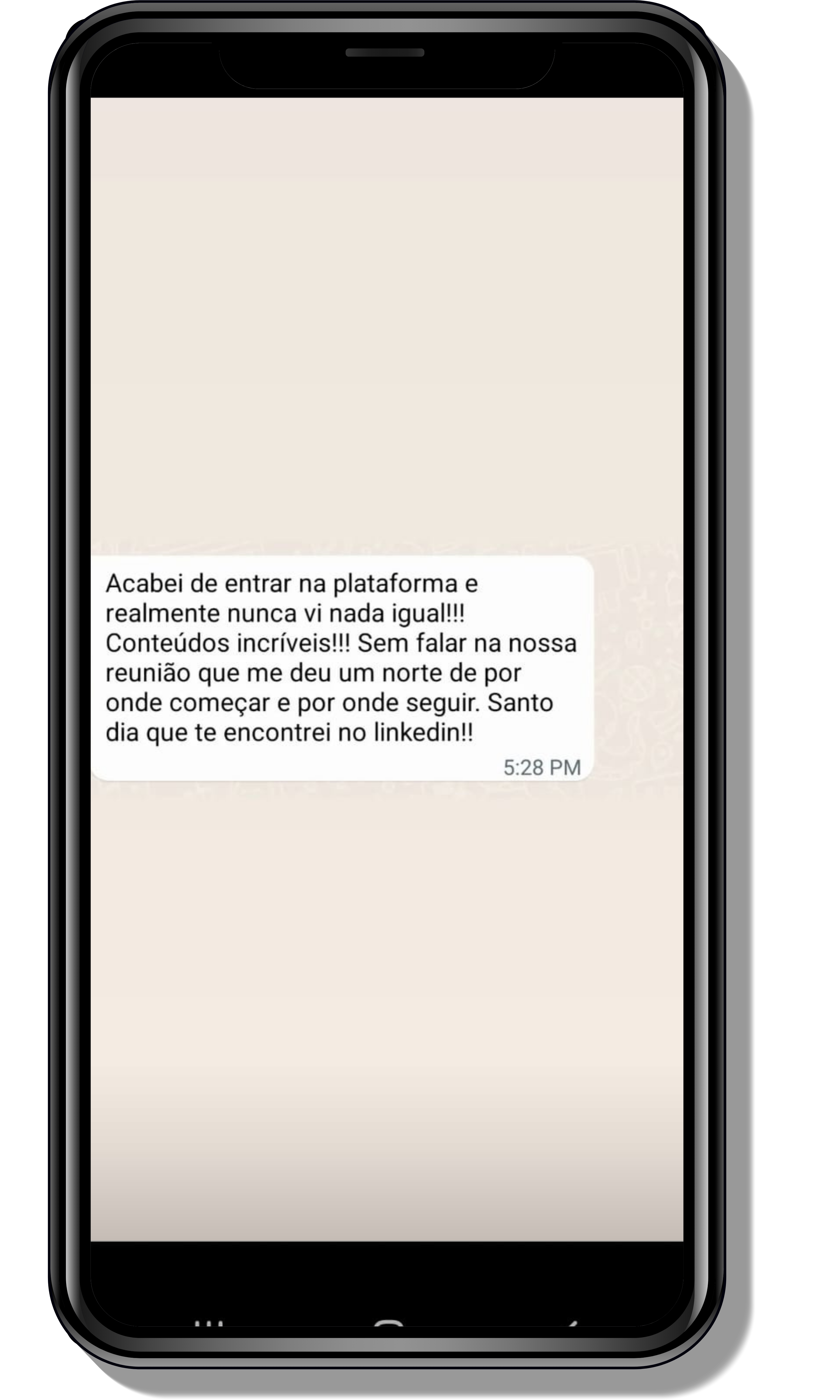
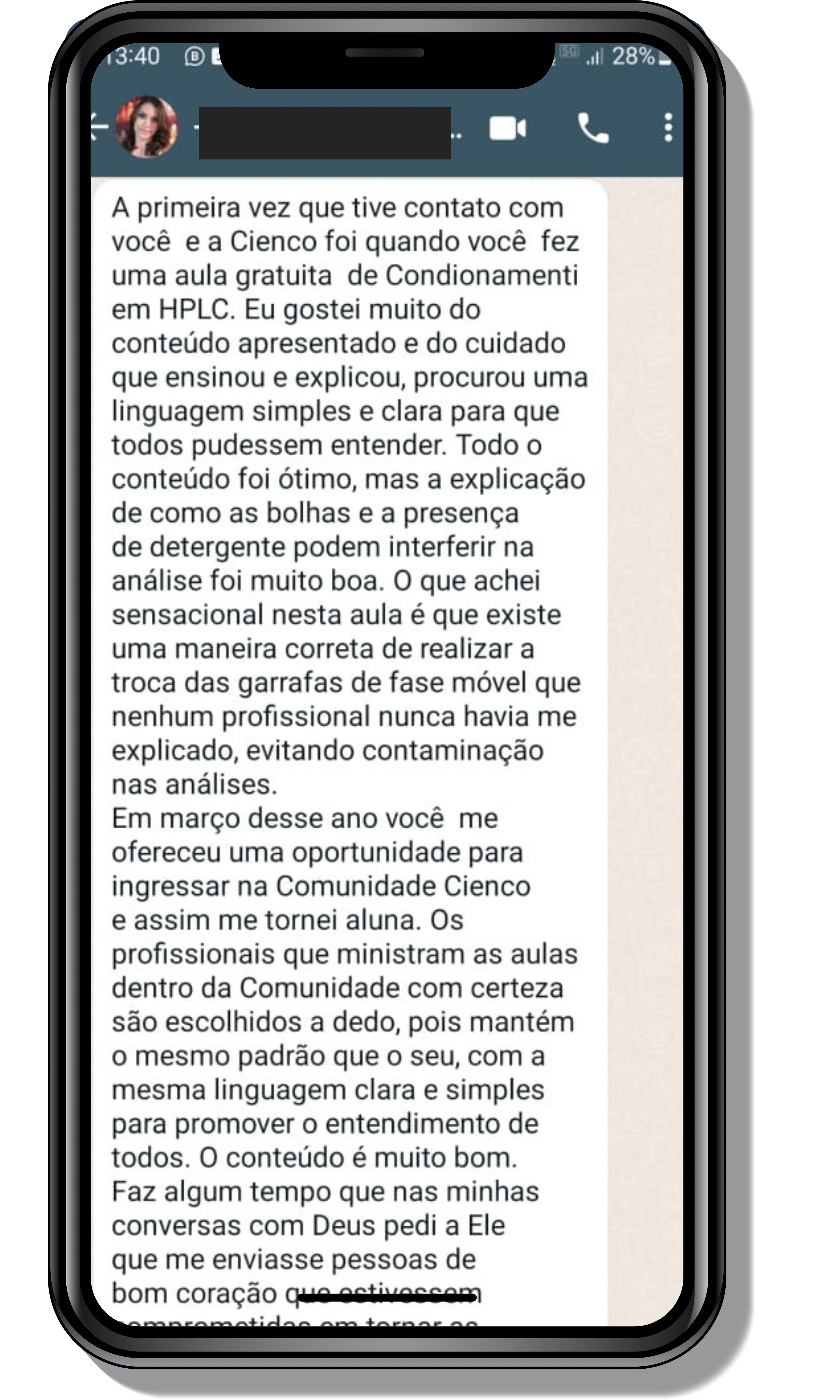
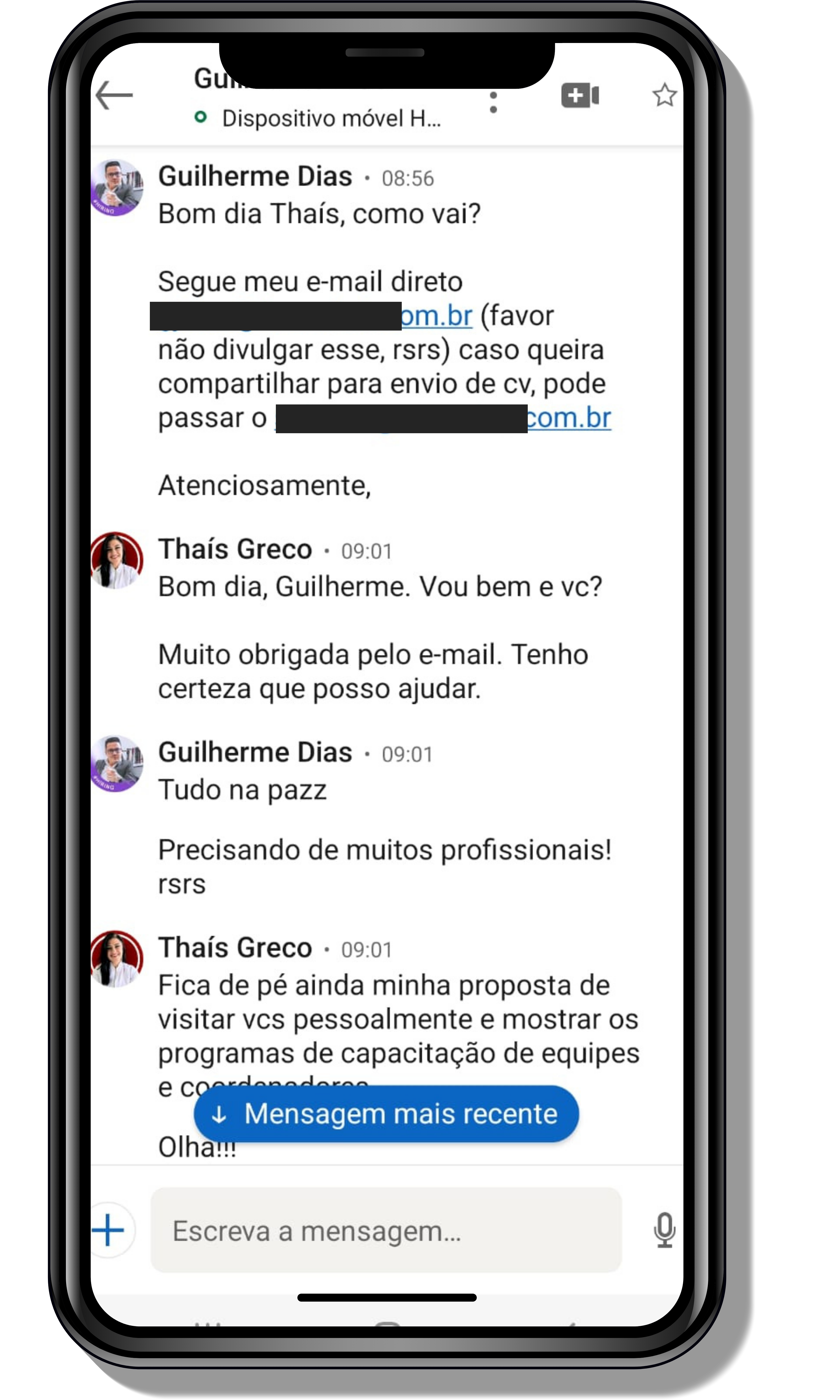
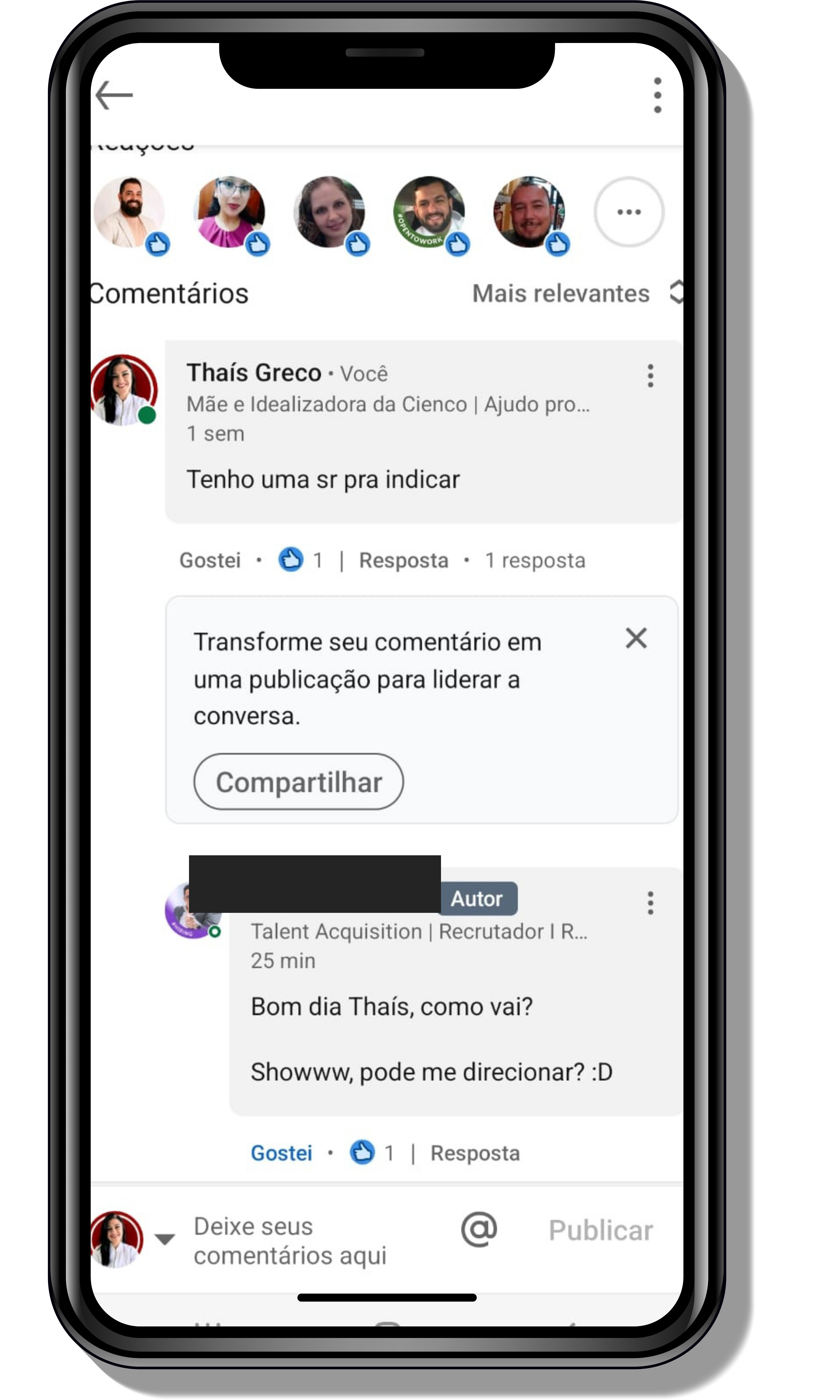
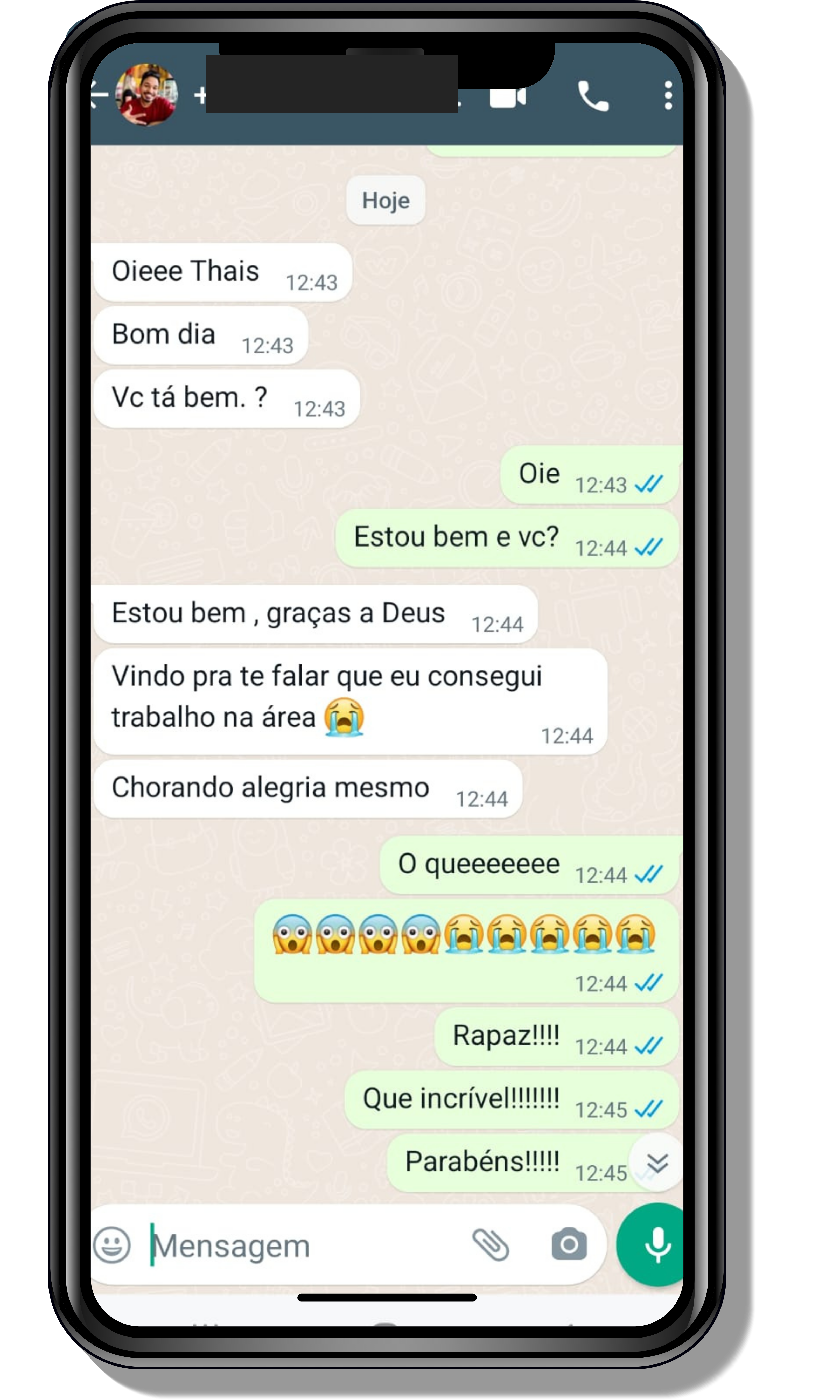
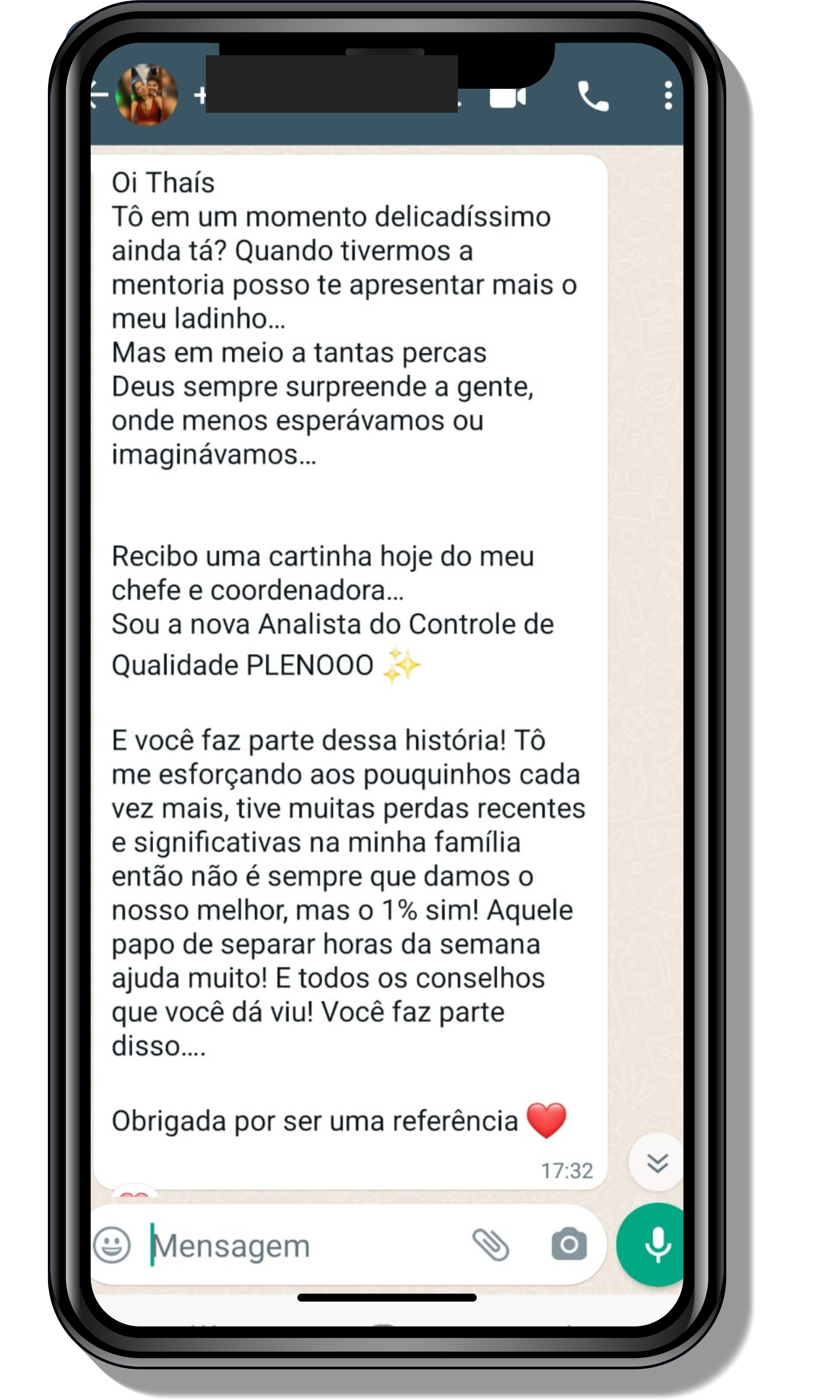
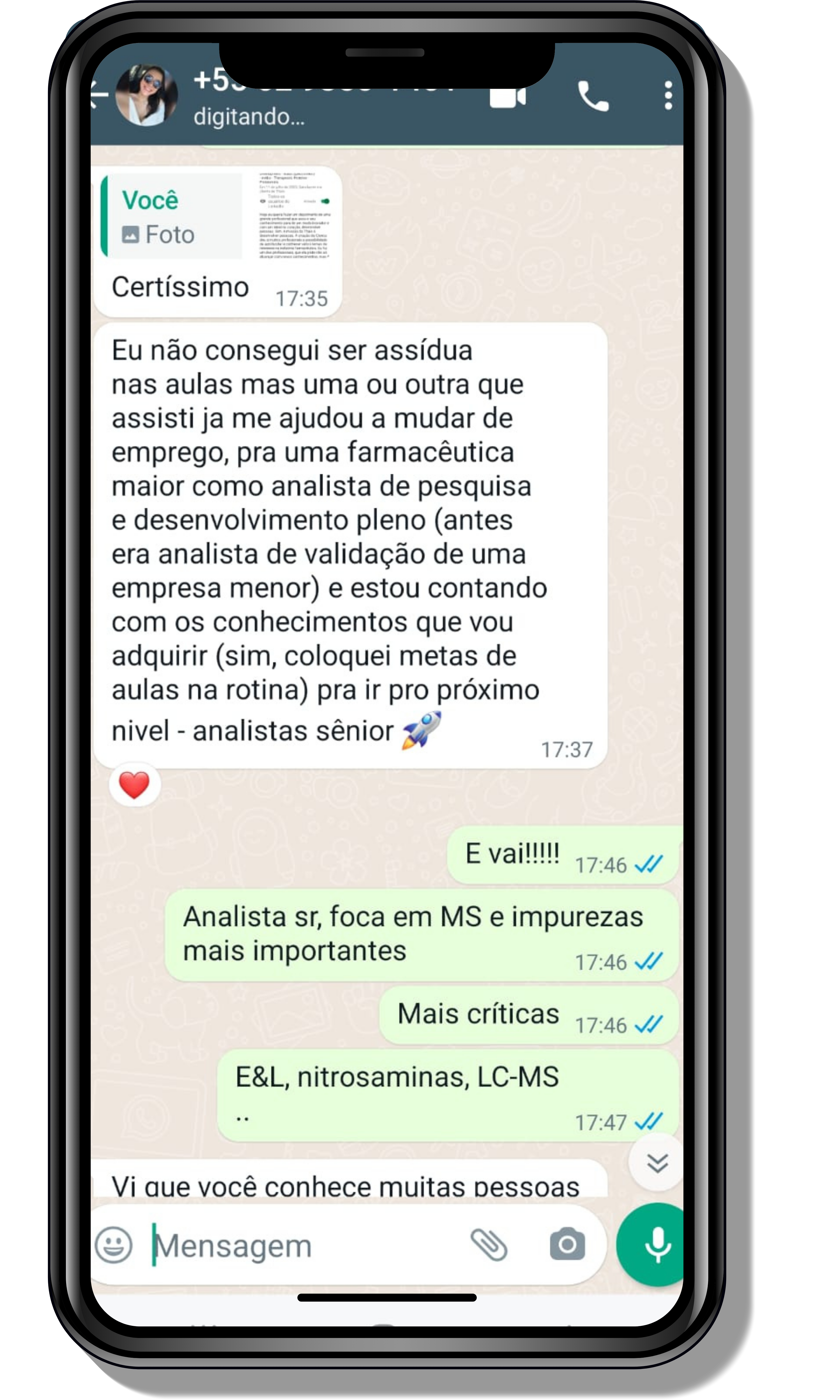
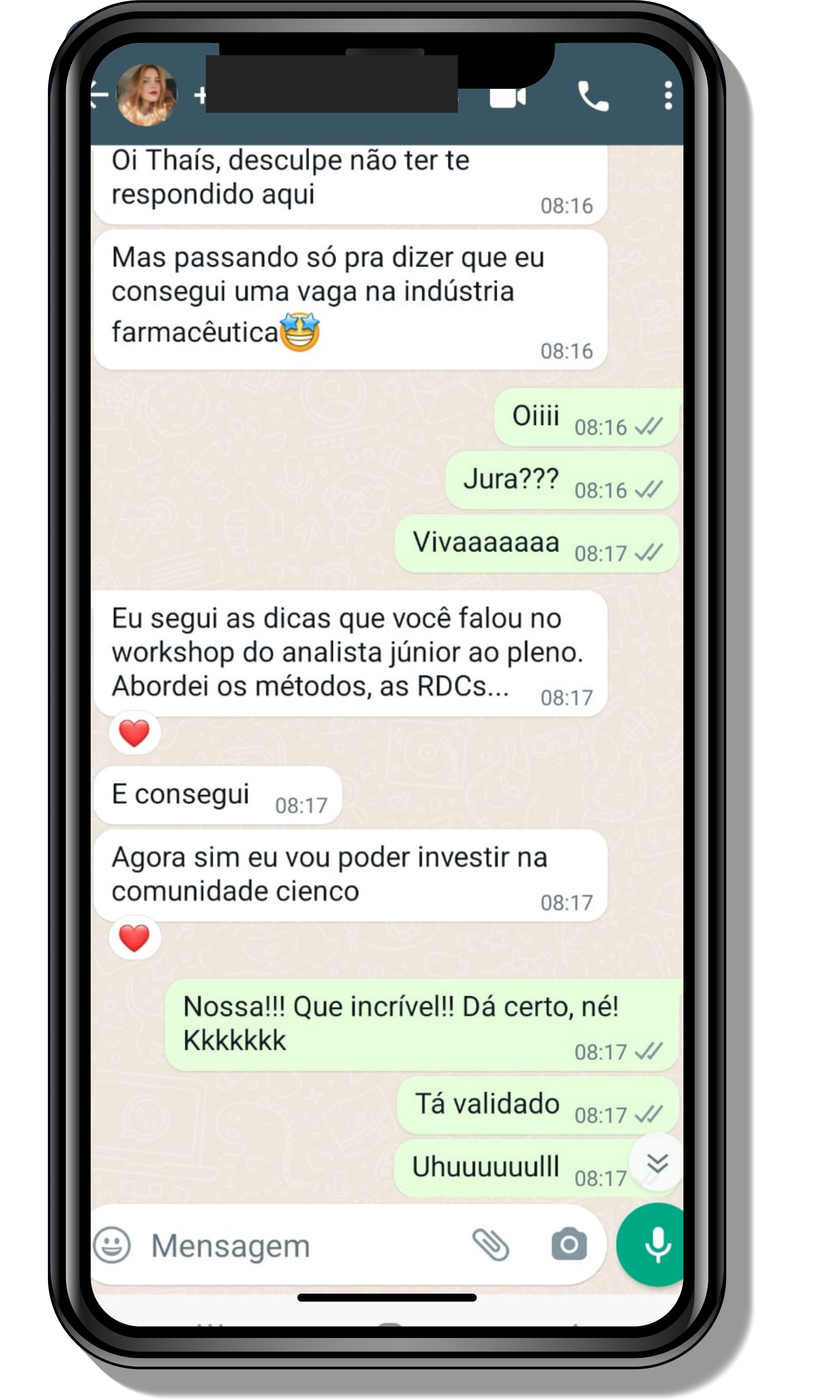
Entre em contato
Prefere ser atendido pela nossa equipe?
Entre em contato via Whatsapp clicando no botão abaixo e iremos te ajudar a encontrar a melhor solução pra você ou para a sua equipe.